Може би вече сте чували за нещо, което наричаме елемент. Всеки материал, който използваме в нашия всекидневен живот, включително нашата тъкан и кости, са направени от тези елементи, чийто брой е изненадващо малък.
Какво прави елементите различни едни от други?
На този въпрос ще отговорим по-пълно, когато стигнем до детайлното обяснение на структурата на атомите.
Елементите се различават на атомно ниво. Златото има различни свойства от магнезия, защото отделните атоми имат по-различна структура. Тази разлика може да повлияе на техните физични свойства, като агрегатното състояние на елемента в неговата чиста форма (например златото е лъскаво, твърдо, жълто вещество, докато магнезия е сребрист и по-мек), но най-вече на техните химически свойства, и по-точно как те взаимодействат с другите вещества (златото взаимодейства изключително слабо, докато магнезият взаимодейства силно с вода).
Техните структурни различия също така влияят и на това как те се съчетават с други елементи.
Съществува много полезно средство, наречено Периодична система на химическите елементи, която организира елементите съгласно тяхната атомна структура, и следователно и техните свойства. Тя също ще бъде разгледана в детайли по-нататък.
Елементите, от които се състои всичко, което виждаме не могат да бъдат получени по изкуствен начин. Те съществуват естествено в природата. Въпросът е - от къде идва целият този въглерод, от който сме направени? Всички стабилни елементи, които виждаме идват от космоса, далеч извън Земята. Леките елементи до желязото са получени от процес, наречен ядрен синтез, който протича в ядрата на звездите. Елементите над желязото са получени при смъртта на звездите, в гигантски експлозии, наречени супернова. И двата процеса ще бъдат обяснени подробно в следващия раздел. Това може да Ви даде представа защо има повече въглерод, отколкото злато във Вселената, ако вземете предвид, че само най-масивните звезди могат да изгарят по-тежките елементи, като златото и да се превърнат в супернова.
Предположението за съществуването на атомите идва още от древните гърци. Философът Демокрит стига до заключението, че има точка, при която той няма да може да разреже хляба си на по-малки парчета - те просто стават неделими. Той предполага, че всичко би трябвало да се състои от някакви фундаментални съставни части, които не могат да бъдат разрушени и той ги нарича с гръцката дума "atomos", което означава "неделим".
Съвременното разбиране за атома се оформя с развитието на химията. Джон Далтон забелязъл, че 8 грама кислород винаги се свързват с точно 1 грам водород. Това довело до създаването на теорията, че определен брой обекти от елемент в микросвета се свързва с определен брой от друг елемент и всеки от тези обекти е раличен за всеки елемент. Това довело до развитие на идеята за атомите. Докато химиците са създали основната идея за атомите, физиците са тези, които са открили, че от атомите зависи повече, отколкото се е предполагало в началото.
Откриването на ядрото
След като атомите станали общоприета идея за строежа на материалите в микроскопичен мащаб учените започнали да създават теории, с които да опишат свойствата на атомите. Например, защо атомите на златото се държат по-различно от атомите на магнезия. Една от най-широко приетите първоначални теории била тази, наречена "Теория на сливовия пудинг". При този модел атомът се разглеждал като море от положителни заряди, разбъркано с отрицателни заряди, които се неутрализират един друг, което прави атома неутрален.
Първите доказателства, че реалната структура на атомите е напълно различна са получени при експеримента на Ръдърфорд през 1911 година. Той бомбардира фино златно фолио (с дебелина само няколко атома) с това, което е било познато по това време като "алфа частици" - положително заредени частици, за които в днешно време се знае, че представляват хелиеви ядра.
Ръдърфорд открил, че вместо всички частици да отскачат назад към детектора, след като са се сблъскали с атомите (което всъщност правели само малка част от тях), някои се отклонявали на малки ъгли, а други преминавали през фолиото. Този факт накарал Ръдърфорд да заключи, че атомите всъщност имат много малък обем с положителен заряд в центъра си, което кара алфа частиците, които се удрят в него челно да отскачат. Също така, той разбрал, че по-голяма част от обема на атома трябва да е празно пространство, което обяснява факта, че по-голямата част от частиците преминават през него.
От друга страна, тези частици, които са се отклонили леко трябва да са преминали много близо до положително зареденото ядро и в резултат на това да са били отблъснати от подобен заряд.
В резултат на тези надлюдения и заключения окончателният модел на Ръдърфорд се състоял от малко топче с положителен заряд в центъра на атома, което той разглеждал като ядро и обикалящи около него отрицателно заредени електрони, по подобие на планетните орбити в Слъчевата система, с цел да се осигури неутралността на атома. Този модел се превърнал в общоприета теория, докато малко по-късните квантово-физични експерименти не показали, че това не е точно така.
Ядрото
Както показва името, ядрените физици фокусират своя интерес върху поведението на ядрата на атомите, тъй като за тях това е ключа към разбирането на тяхната структура. Електроните вече са били открити от Дж. Дж. Томпсън, когато той показва, че катодните лъчи всъщност се състоят от отрицателно заредени частици, чието отношение заряд/маса е измерено прецизно по-късно в експеримента на Миликан със заредените капки масло. Много години преди експеримента на Ръдърфорд се е предполагало, че всички атоми се състоят от атомите на водорода, което е почти вярно. През 1917 година Ръдърфорд извършва експеримент, при който чист азот се бомбардира от алфа частици. Детекторите му показали получени сигнали за наличие на водородни ядра, което довело до заключението, че те трябва да са се излъчили от азотните ядра след сблъсъка с алфа частиците. Ръдърфорд прави заключение, че това означава, че ядрото на азота се състои от водородни ядра, или протони. Това се смята за първата осъществена документирана ядрена реакция.
В следствие на това учените създали концепцията за маса и атомни номера.
Масовото число е реалната маса на атома (всъщност ние можем да приемем, че това е и масата на ядрото, тъй като масата не електроните е пренебрежимо малка), а атомният номер е броя на протоните, или броя на електроните в атома.
Съществуването на неутрона за първи път е предположено от Ръдърфорд през 1920 година, с което той се опитва да обясни разликата между атомните и масовите числа на ядрата. Въпреки това Джеймс Чадуик е този, който през 1932 показва, че един тип излъчване, което преди това се е считало за гама-лъчение всъщност се състои от неутрални частици с маса, приблизително равна на масата на протоните.
Частиците били наречени неутрони и били включени в ядрената теория като липсващата маса.
Общият термин, с който се наричат протоните и неутроните, които се намират в ядрото, е нуклони. Нуклоните се задържат заедно под действието на ядрената сила, реазултат от силното взаимодействие. Това е едно от четирите фундаментални взаимодействия във Вселената (силно, слабо, електромагнитно и гравитационно взаимодействия). Тази сила е приблизително 1038 пъти по-силна от гравитацията, действа само на разстояния от порядъка на 10-15 м, и преодолява електростатичното отблъскване между подобните положителни заряди на протоните.
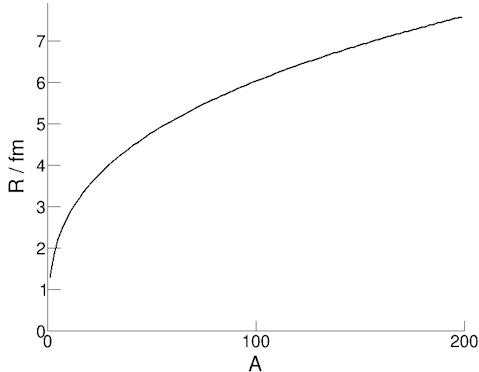
Можем да намерим радиуса на ядрото, като го бомбардираме с електрони и наблюдаваме разпределението в тяхното разсейване. Като използваме пресмятания, при които отчитаме запазването на импулса в този случай, от експериментите се вижда, че радиусът на ядрото може да се опише сравнително точно със следната формула:
R = r0 A1/3
където R е радиуса на ядрото, A е броя на нуклоните, а r0 е константа (радиусът на нуклон ≈ 1.3 fm).