Vous avez peut-être déjà entendu parler de ce que nous appelons un élément. Toute la matière que nous rencontrons dans notre vie quotidienne, y compris nos propres tissus et nos os, est faite de ces éléments, et d’un nombre étonnamment faible d'entre eux.
Qu’est-ce qui rend un élément différent d'un autre?
Cette question sera traitée plus globalement lorsque nous allons détailler la structure des atomes. Les éléments diffèrent à l'échelle atomique, l'or a des propriétés différentes de celles de magnésium parce que les atomes individuels de la matière ont des structures légèrement différentes. Cette différence peut affecter les propriétés physiques, telles que l'apparence de l'élément dans sa forme pure (l'or est une substance dure, brillante, jaune, alors que le magnésium est argenté et plus souple) et, surtout, les propriétés chimiques, ou la façon dont les atomes interagissent avec d'autres substances (l’or est extrêmement non-réactif, alors que le magnésium réagit facilement avec l'eau). Leurs différences structurelles affectent aussi la façon dont ils se combinent avec d'autres éléments.
Il est un outil utile, appelé le Tableau périodique, qui organise les éléments en fonction de leur structure atomique, et par conséquent, leurs propriétés. Ce sera également examiné en détail un peu plus loin.
Les éléments qui composent tout ce que nous voyons ne peuvent pas être produits synthétiquement, mais sont plutôt présents naturellement. Alors d'où vient tout le carbone dont nous sommes faits? Tous les éléments stables que nous voyons viennent en réalité d’au-delà de la Terre, de l'espace. Les éléments légers jusqu'au fer, sont produits dans un processus appelé nucléosynthèse dans les cœurs des étoiles. Les éléments plus lourds sont créés lorsque les étoiles meurent dans des explosions gigantesques appelées supernovae. Ces deux processus seront expliqués plus en détail dans un autre chapitre. Cela peut vous donner un indice quant à pourquoi il y a plus de carbone que d'or dans l'Univers, si l'on considère que seules les étoiles les plus massives peuvent brûler des éléments plus lourds comme l'or et devenir des supernovae.
Les atomes ont été imaginés de façon théorique déjà à l'époque des Grecs anciens, lorsque le philosophe Démocrite s'est rendu compte qu’à un certain moment, il ne pouvait pas découper son pain en parts plus petites : ces parts étaient indivisibles. Il a suggéré que tout dans la Nature doit être fait de ces éléments fondamentaux, qui ne peuvent être détruits, et il les nomma d’après le mot grec « atomos », signifiant « pas de coupure » .
Cependant, une idée plus moderne des atomes a commencé avec la chimie. John Dalton a remarqué que 8 grammes d'oxygène étaient toujours combinés avec 1 gramme d'hydrogène exactement. Cela a conduit à la théorie selon laquelle un certain nombre d'objets d'un élément sur une petite échelle doit se combiner avec un certain nombre d’autres objets, et chacun de ces objets était différent pour chaque élément. Cette théorie a évolué dans l'idée d'atomes. Alors que les chimistes ont eu l'idée de base des atomes, ce sont les physiciens qui ont découvert qu'il y avait plus dans l'atome que ce qu'ils pensaient d’abord.
La découverte du noyau
Alors que les atomes étaient devenus une idée acceptée de la structure des matériaux à très petite échelle, les scientifiques ont commencé à théoriser sur ce qui donne ses propriétés à l’atome; pourquoi les atomes d'or se comportent différemment des atomes de magnésium. Une des théories les plus largement acceptées, est le «modèle de Plum Pudding ». Dans ce modèle, l'atome était une mer de charges positives entrecoupée de charges négatives, qui s’annulent les unes les autres de sorte que l'atome est neutre.
La première preuve que la structure réelle était complètement différente a été trouvée lors de la célèbre expérience de Rutherford en 1911. Il a bombardé une feuille d’or (d’une épaisseur de quelques atomes) avec ce qu'il savait être des particules alpha, particules chargées positivement, qui sont aujourd'hui connues pour être des noyaux d'hélium . Il a constaté que, au lieu de rebondir vers l'arrière au niveau du détecteur après avoir heurté les atomes (c’était le cas seulement d’un très petit nombre d’alphas) , certaines particules ont été déviées à faibles angles et certaines traversèrent la feuille. Rutherford, inspiré, conclut que les atomes ont une très petite zone de charge positive en leur centre, ce qui a amené les particules alpha qui ont frappé cette zone de front à rebondir. Il s’est également rendu compte que la plus grande partie de l'atome doit être composé d'un espace vide puisque la majorité des particules passe tout droit. Les particules qui ont été déviées légèrement, sont passées près de la charge positive au centre et ont été repoussées comme par une charge électrique.
Son modèle final comprenait une petite boule de charge positive dans le centre de l’atome, qu'il a considéré comme le noyau, et afin que l'atome soit neutre, les électrons négatifs évoluaient en orbite autour de ce noyau d'une manière similaire aux orbites planétaires. Ce modèle a été la théorie acceptée jusqu'à ce que les expériences un peu plus modernes de la physique quantique aient montré que ce n'était pas tout à fait exact.
Le noyau
Comme le titre l'indique, les physiciens nucléaires se concentrent sur le comportement des noyaux des atomes, il est donc essentiel pour eux de comprendre sa structure. Les électrons avaient déjà été découverts par J.J. Thomson quand il a montré que les rayons cathodiques étaient constitués de particules chargées négativement, dont le rapport charge/masse a été mesuré plus tard dans l'expérience de Millikan sur des gouttes d'huile chargées. Il a été suggéré de nombreuses années avant l'expérience de Rutherford que tous les atomes seraient faits d'atomes d’hydrogène, ce qui était presque correct. En 1917, Rutherford a réalisé une expérience qui a consisté en un tir de
particules alpha dans de l’azote gazeux pur. Ses détecteurs ont montré des signaux typiques de noyaux d'hydrogène et il a conclu qu'ils devaient avoir été émis par les noyaux d'azote suite aux collisions avec les particules alpha. Il a décidé que cela signifiait que le noyau d'azote contenait des noyaux d'hydrogène, encore appelés protons. C'est aussi la première réaction nucléaire observée.
À ce stade, les scientifiques ont mis au point le concept de nombre de masse et de numéro atomique.
Le nombre de masse est la masse réelle de l'atome (nous pouvons supposer que c'est la masse du noyau, les électrons ont une masse négligeable) et le numéro atomique est le nombre de protons, ou le nombre d'électrons dans l'atome. L'existence du neutron a d'abord été suggérée par Rutherford en 1920 pour tenir compte de l'écart entre les numéros atomiques et les nombre de masse des noyaux. Cependant, c'est James Chadwick en 1932 qui a montré que le rayonnement, que l'on croyait être des rayons gamma, était en fait constitué de particules neutres de masse approximativement égale à celle des protons. Ces particules ont été appelés neutrons et introduites dans la théorie nucléaire comme la masse manquante.
Le terme collectif pour les protons et les neutrons, tout deux résidant dans le noyau, est « nucléons ». Les nucléons sont maintenus ensemble par la force forte, qui est l'une des quatre forces fondamentales de l'univers. Cette force particulière est environ 1038 fois plus forte que la gravité, agit seulement à une distance de 10-15 m, et surpasse la répulsion électrostatique entre les charges positives des protons.
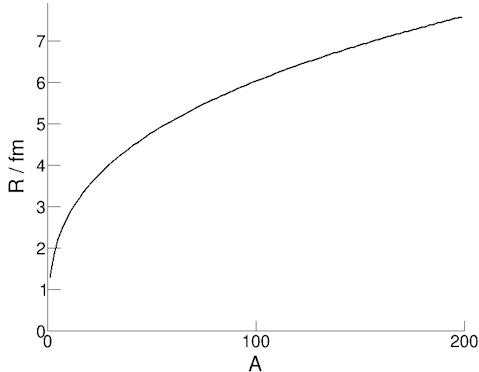
Nous pouvons trouver le rayon d'un noyau en diffusant des électrons hors des noyaux et en étudiant la structure de cette diffusion. Alors que nous pouvons faire un calcul en utilisant la conservation du moment dans ce scénario, des expériences ont montré que l'équation pour le rayon est plus précisément celle-ci :
R = r0 A1/3
Dans cette équation, R est le rayon, A est le nombre de nucléons, et r0 est une constante (le rayon d'un nucléon ≈ 1.3 fm).