Je hebt zeker al gehoord van de elementen. Elk materiaal waarmee we in het dagelijks leven te maken hebben, inclusief wijzelf, onze botten en organen en al de andere delen van ons lichaam, is gemaakt van deze elementen, en zelfs van maar een verbazend klein aantal ervan.
Wat onderscheidt het ene element van het andere?
Deze vraag zal meer volledig beantwoord worden wanneer we later de structuur van atomen in meer detail zullen toelichten. Elementen zijn verschillende soorten van atomen. Goud heeft andere eigenschappen dan magnesium omdat goudatomen en magnesiumatomen een lichtjes verschillende structuur hebben. Deze verschillen bepalen de fysische eigenschappen van de elementen, zoals hun uitzicht in zuivere vorm (goud is een hard, geel en glanzend materiaal, terwijl magnesium zachter is en zilverkleurig). De verschillen in atomaire structuur bepalen ook, en dit is misschien nog belangrijker, de chemische of scheikundige eigenschappen van de elementen, en dus hoe ze met andere elementen en andere stoffen interageren (goud reageert zo goed als niet, terwijl magnesium zeer gemakkelijk reageert met water bijvoorbeeld).
In de Periodieke Tabel van de elementen, ook wel de Tabel van Mendeljev genoemd, zijn de verschillende elementen gegroepeerd volgens hun atomaire structuur, en dus volgens hun eigenschappen. Ook hier zullen we later in meer detail op ingaan.
De elementen waarvan alles rondom ons gemaakt is kunnen niet zomaar (of toch niet eenvoudig, en zeker niet in bruikbare hoeveelheden) door de mens gemaakt worden, maar worden gevonden in de natuur en meestal in de bodem. Waar komt al het koolstof in ons lichaam dan vandaan? Al de stabiele (in de kernfysica bedoelt men met deze term de niet-radioactieve) elementen die we kennen zijn in feite gemaakt in de ruimte, ver weg van de Aarde. De allerlichtste elementen, zoals waterstof en helium, zijn geproduceerd door de Big Bang, de grote ontploffing waaruit ons Heelal ontstaan is. Al de andere lichte elementen, tot en met ijzer, zijn geproduceerd in het binnenste van sterren door een proces dat we nucleosynthese noemen. De elementen zwaarder dan ijzer worden gevormd wanneer zware sterren aan het einde van hun leven ‘sterven’ in een gigantische explosie die we supernova noemen. Dit verklaart meteen waarom er in het heelal minder goud dan koolstof aanwezig is, want alleen de allerzwaarste sterren evolueren tot een supernova-explosie waarin de zware elementen, zoals goud, kunnen gevormd worden.
In de tijd van de oude Grieken werd voor het eerst verondersteld dat er zoiets als atomen zou bestaan. De Griekse filosoof Democritos realiseerde zich dat het vanaf een bepaald punt niet meer mogelijk was om zijn brood in nog kleinere stukjes te snijden: het was dan verder “ondeelbaar”. Hij suggereerde daarom dat alles moet bestaan uit “fundamentele”, zeg de kleinste, bouwstenen, die niet verder kunnen worden opgedeeld in nog kleinere entiteiten, en die hij in het Grieks “atomos” noemde, wat “ondeelbaar” betekent.
Een meer modern begrip van wat atomen zijn is afkomstig uit de scheikunde. John Dalton merkte dat steeds exact 8 gram zuurstof met exact 1 gram waterstof reageert bij de vorming van water. Dit leidde tot de theorie dat steeds een welbepaald aantal kleine onderdelen van een bepaald element moeten combineren met een welbepaald aantal van dergelijke kleine onderdelen van een ander element, en dat deze onderdelen bovendien voor elk element verschillend moeten zijn om de waargenomen verschillen in gewicht te kunnen verklaren. Dit leidde uiteindelijk tot het concept van atomen voor deze kleine onderdelen van de elementen. Terwijl het idee van atomen dus afkomstig is van de scheikunde, waren het de natuurkundigen of fysici die merkten dat een atoom in werkelijkheid een veel complexere structuur heeft dan men aanvankelijk dacht.
De ontdekking van de atoomkern
Zodra het idee dat atomen deel uitmaken van de kleine-schaal-structuur van materialen aanvaard was, begonnen wetenschappers na te denken over de oorsprong van de eigenschappen van de verschillende soorten atomen (de elementen) die in de natuur voorkomen; bijvoorbeeld waarom goudatomen zich anders gedragen dan magnesiumatomen. Eén van de meest aanvaarde theorieën was die van het “pudding model”. In dit model wordt een atoom beschouwd als een groep van positieve ladingen die het ganse volume van het atoom vullen en met daartussen evenveel negatieve ladingen, zodat het atoom als geheel elektrisch neutraal is.
De eerste aanwijzingen dat de werkelijke structuur van het atoom in feite echter totaal verschillend is werden gevonden in een intussen beroemd geworden experiment dat Rutherford uitvoerde in 1911. Hij bombardeerde een zeer dunne goudfolie (met een dikte van slechts enkele atoomlagen) met zogenaamde alfa-deeltjes die werden uitgezonden door een radioactief materiaal. Alfa-deeltjes zijn positief geladen deeltjes waarvan we nu weten dat het de kernen van heliumatomen zijn. Rutherford merkte dat, op enkele uitzonderingen na, de alfa-deeltjes niet terugkaatsten wanneer ze de folie raakten. Als het volume van de atomen in de folie volledig is opgevuld, zoals het “pudding model” stelde, zou je dat nochtans verwachten. De meeste alfa-deeltjes bleken echter recht door de folie te gaan waarbij een klein aantal zelfs lichtjes van richting veranderden. Hieruit leidde Rutherford af dat de positieve lading in atomen in feite maar in een zeer klein gebied in het centrum van de atomen geconcentreerd moet zijn. Alleen alfa-deeltjes die recht op die positieve lading botsen worden dan teruggekaatst. Het feit dat het overgrote deel van de alfa-deeltjes ongestoord door de folie bleek te vliegen deed hem verder besluiten dat het volume van een atoom eigenlijk leeg is. De alfa-deeltjes die licht werden afgebogen in de folie waren dan die welke dicht in de buurt van een atoomkern waren gekomen en dan door de positieve lading van de kern waren afgestoten (alfa-deeltjes hebben ook een positieve elektrische lading).
Rutherford beschreef het atoom daarom als een klein, positief geladen bolletje in het centrum, de atoomkern, waarrond een aantal negatief geladen elektronen bewegen (zoals de planeten rond de zon), zodat het atoom als geheel elektrisch neutraal is. Dit atoommodel van Rutherford werd algemeen aanvaard tot meer gedetailleerde experimenten in de kwantumfysica later leerden dat ook dit model nog niet helemaal juist was.
De atoomkern
Zoals de titel al suggereert, concentreren kernfysici zich op het gedrag van de kernen van atomen, zodat het van groot belang is dat de structuur van het atoom als geheel goed begrepen wordt. Elektronen waren eerder al door J.J. Thomson ontdekt toen die aantoonde dat de zogenaamde kathodestralen waarmee men in die tijd experimenten uitvoerde in feite deeltjes waren met een negatieve lading. De juiste verhouding van de lading en de massa van het elektron werd later bepaald door Millikan in zijn experiment met elektrisch geladen oliedruppels. Lang voor Rutherford’s experiment was er al gesuggereerd dat al de atomen zouden zijn opgebouwd uit waterstofatomen (het kleinste atoom), wat in feite vrij dicht bij de waarheid is. In 1917 voerde Rutherford een nieuw experiment uit waarbij hij
alfa deeltjes schoot in een volume dat volledig met zuiver stikstofgas gevuld was. Zijn detectoren registreerden signalen afkomstig van atoomkernen van waterstof en hij leidde hieruit af dat die moesten zijn vrijgemaakt uit atoomkernen van stikstof bij de botsing met een alfa-deeltje. Hij besloot dat de atoomkern van stikstof dus atoomkernen van waterstof (protonen), moet bevatten. Dit experiment was tegelijk de eerste door de mens uitgevoerde kernreactie.
Op basis van een aantal de experimenten die tot ongeveer 1920 waren uitgevoerd konden wetenschappers het massagetal (ook wel atoommassa genoemd) en het atoomgetal definiëren.
Het massagetal is de eigenlijke massa van het atoom (we kunnen deze in zeer goede benadering gelijk stellen aan de massa van de atoomkern, omdat elektronen maar een zeer kleine massa hebben). Het atoomnummer geeft aan hoeveel protonen er in de kern van het atoom zitten, en dus ook hoeveel elektronen er rond de atoomkern draaien omdat het atoom elektrisch neutraal moet zijn. Als de atoomkern alleen uit protonen bestaat en de elektronen die rond de atoomkern bewegen slechts een zeer kleine massa hebben in vergelijking met een proton, zou je verwachten dat het massagetal en het atoomnummer ongeveer aan elkaar gelijk zijn. De twee getallen bleken echter voor al de gekende elementen ongeveer een factor twee te verschillen. Om dit verschil tussen het atoomnummer en het massagetal van atomen te verklaren, stelde Rutherford in 1920 voor dat er in de atoomkern nog een ander deeltje dan het proton moet voorkomen, dat elektrisch neutraal is, en dat neutron genoemd werd. Het was echter pas in 1932 dat het bestaan van het neutron werd aangetoond toen Chadwick in een experiment waarnam dat een bepaalde soort straling waarvan men tot dan toe had aangenomen dat het gammastraling was (dit zijn hoogenergetische lichtdeeltjes), in feite bleek te bestaan uit neutrale deeltjes met ongeveer dezelfde massa als het proton. Deze deeltjes, neutronen, bleken inderdaad de ontbrekende massa in het atoommodel te kunnen verklaren.
Protonen en neutronen, die samen in de atoomkern (in het Engels “nucleus” genoemd) voorkomen, worden vaak ook samen nucleonen genoemd. De nucleonen worden in de atoomkern samengehouden door de zogenaamde sterke kracht, één van de vier basiskrachten in de natuur. Deze kracht is ongeveer 1038 (een één met 38 nullen) sterker dan de zwaartekracht en ongeveer 100 maal sterker dan de elektromagnetische kracht. Hierdoor kan ze voorkomen dat de elektrische afstoting tussen de protonen in de atoomkern, die allemaal dezelfde lading hebben, de atoomkern uit elkaar zou doen vallen. De sterke kracht is echter maar voelbaar tot op een afstand van 10-15 m (een miljoenste van een miljardste van een meter, ook wel femtometer (fm) genoemd) van een nucleon. Dit is ook ongeveer de afmeting van één enkel nucleon (een proton of een neutron dus). De straal van een nucleon is immers ongeveer 1.3 fm. En een atoomkern is niet zo veel groter.
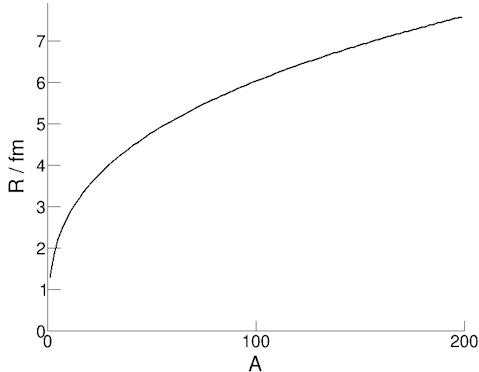
De diameter van een atoomkern kan gemeten worden door elektronen op atoomkernen te schieten en dan te meten in welke richting ze daarna wegvliegen (dit wordt een verstrooiingsexperiment genoemd). Uit dergelijke metingen is gebleken dat de straal, R, van een atoomkern bij benadering gelijk is aan
R = r0 A1/3
met A het massagetal (of dus het aantal protonen en neutronen in de atoomkern), en r0 een constante. In de figuur zie je hoe de straal van een atoomkern toeneemt van ongeveer 2 fm voor de lichte atomen (met een klein massagetal A) tot ongeveer 8 fm voor de zwaarste atomen (met massagetal A ongeveer 200).