
In het vorige hoofdstuk hebben we de schaal van verschillende soorten objecten besproken, met vooral aandacht voor de schaal van de hele kleine dingen, de nanoschaal, en voor wat we weten van atomen en atoomkernen. Nu we de structuur van atomen begrijpen, en in het bijzonder die van de atoomkern zijn we klaar om een aantal andere, meer interessante aspecten, van die atoomkern te bestuderen.
Eén van de grootste studiedomeinen van de kernfysica is radioactiviteit, een natuurlijk verschijnsel waardoor bepaalde atoomkernen van samenstelling veranderen en daarbij bepaalde soorten van straling uitzenden. Van dergelijke atoomkernen zeggen we dat ze radioactief zijn. Radioactiviteit is overal om ons heen: in de aardbodem, in de atmosfeer, en zelfs in ons lichaam. We zijn eigenlijk voortdurend blootgesteld aan straling afkomstig van radioactieve atomen in de omgeving rondom ons, en dus niet alleen wanneer we bijvoorbeeld een röntgenfoto (met X-stralen) laten nemen.
In dit hoofdstuk bespreken we de ontdekking van radioactiviteit en gaan we dieper in op de oorzaak er van. Daarna bespreken we hoe radioactiviteit interageert met de wereld rondom ons.
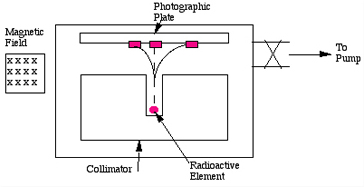
Men heeft vastgesteld dat sommige elementen radioactief zijn (m.a.w. één van de drie soorten straling, alfa-, bèta- of gammastraling uitzenden), en andere niet. Dat betekent dat radioactiviteit ontstaat op het niveau van de atomen. Om het fenomeen radioactiviteit beter te begrijpen moeten we dus atomen bestuderen en, zoals gebleken is, vooral atoomkernen. Radioactieve atomen kunnen dus drie soorten straling uitzenden: alfa-, bèta- en gammastraling. Dit zijn deeltjes of energiepakketjes die door de kern van onstabiele atomen worden uitgezonden. Men kan deze soorten straling ook zien als het verval van atomen, door instabiliteit, naar een ander soort atoom (een ander element).
Maar waarom zijn bepaalde atomen wel onstabiel en andere niet?
Dit zal uitgelegd worden in een later hoofdstuk, maar voorlopig houden we het er op dat dit het gevolg is van het aantal nucleonen in de kern, meer bepaald de verhouding tussen het aantal protonen en neutronen in de kern van het atoom. De drie verschillende soorten straling zijn het gevolg van verschillende soorten van instabiliteit. Dit is de reden waarom verschillende materialen (atomen) verschillende soorten straling uitzenden.
Instabiliteit is niet beperkt tot een aantal atoomkernen. Ook neutronen vervallen (de typische tijdschaal hiervoor is ongeveer 15 minuten) en zelfs protonen zullen uiteindelijk vervallen, hoewel men weet dat dit heel erg lang zal duren, namelijk minstens 1034 jaar. Als we dit vergelijken met de tijd dat er al menselijk leven op aarde is (al enkele miljoenen jaren, of dus ongeveer 6 jaar) kunnen we protonen dus beschouwen als stabiele deeltjes.
Nu we al een iets beter idee hebben van wat radioactiviteit precies is kunnen we gaan kijken waar we het kunnen vinden.
Radioactiviteit blijft niet beperkt tot de eerder gevaarlijke elementen zoals uranium of radium. Uranium en radium zijn de sterkste radioactieve bronnen die we kennen, maar radioactiviteit is op veel meer plaatsen aanwezig. De straling die Becquerel ontdekte en die afkomstig is van uranium vinden we ook terug in rotsen, in de lucht die we inademen, in het water dat we drinken, in de zee waarin we zwemmen, in de ruimte, en zelfs in ons eigen lichaam. Het zal je verbazen dat jijzelf en alle mensen die je kent radioactief zijn. Je zou misschien denken dat dit komt door de moderne en technologische wereld die we ontwikkeld hebben met o.a. kerncentrales, computers en röntgenstralen voor medische toepassingen, ... Dit is echter niet de oorzaak. Al zolang er leven op aarde is zijn alle planten en dieren radioactief. Het is een deel van de geschiedenis van het leven op aarde. Alle levende organismen (ook de mens) hebben zich in de loop van de tijd aangepast aan de aanwezigheid van ‘natuurlijke’ radioactiviteit in de omgeving. Laten we nu eens meer in detail gaan kijken waar radioactiviteit in onze omgeving te vinden is.
Radioactieve elementen kunnen we overal op aarde terugvinden. Veel mineralen, in het bijzonder graniet, bevatten uraniumverbindingen. Eigenlijk is uranium even overvloedig aanwezig in de aardbodem als andere gesteenten en metalen, zoals tin, zink of wolfraam. Een andere radioactief element, namelijk thorium, komt zelfs nog drie keer meer voor op aarde dan uranium. In de negentiende eeuw, toen men van verlichting met gas overschakelde naar elektrische verlichting werd thorium gebruikt om gaslampen feller te laten gloeien. En in de huidige, eenentwintigste eeuw zal thorium zeker gebruikt worden als brandstof in kerncentrales.

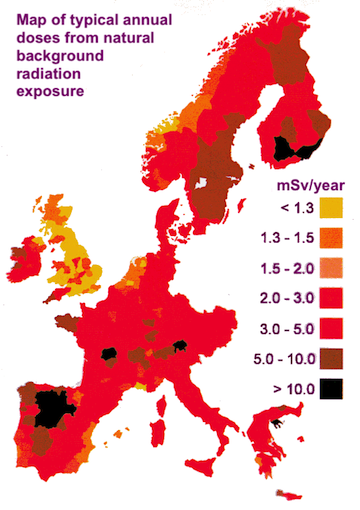
De kaart toont hoeveel achtergrondstraling er aanwezig is in verschillende delen van Europa. De verschillen tussen bepaalde gebieden zijn vooral het gevolg van de verschillende gesteenten die in bepaalde gebieden in de ondergrond aanwezig zijn. Zo bestaat de bodem in het zuidwesten van Engeland bijvoorbeeld vooral uit graniet. De achtergrondstraling in dit gebied is daardoor hoger dan in de rest van Engeland, waar de bodem vooral uit kalksteen bestaat. In graniet zit namelijk uranium dat in zijn radioactief vervalproces radongas produceert. Dit gas, dat alfastraling uitzendt, kan uit het gesteente naar buiten sijpelen waarna het in de lucht terecht komt en wij het kunnen in- en weer uitademen. Er is een (kleine) kans dat dit radioactief radongas zijn alfastraling uitzendt terwijl het zich in onze longen bevindt. Ook in bepaalde gebieden in centraal Frankrijk zijn er hoge stralingsniveaus door radongas dat vrijkomt uit de rotsen in de bodem daar. En in Wallonië is door de rotsachtige bodem en het feit dat veel huizen daar met natuursteen gebouwd zijn, het stralingsniveau ten gevolge van radongas ongeveer drie keer hoger dan in Vlaanderen. Naast rotsen zijn er echter ook nog andere factoren die bijdragen tot de achtergrondstraling.
In het uitgestrekte universum zijn er heel veel objecten die verschillende soorten straling uitzenden, zoals bijvoorbeeld radiosterrenstelsels, zwarte gaten en zelfs de planeten in ons eigen zonnestelsel. Astronomen gebruiken gespecialiseerde telescopen om die verschillende soorten straling, waaronder ook röntgenstralen (of X-stralen) en gammastralen, te detecteren (X-stralen zijn een vorm van gammastraling met lagere energie). Al die objecten zenden straling uit in alle richtingen en zelfs straling uitgezonden door objecten die honderdduizenden lichtjaren van ons verwijderd zijn, kan ons uiteindelijk bereiken. Deze straling die uit alle richtingen komt zonder dat we precies weten welk object ze heeft uitgezonden noemen we kosmische straling. Hoe hoger je boven het aardoppervlak gaat met een detector hoe meer kosmische straling er gemeten wordt. Op bergtoppen zal er dus veel meer straling gedetecteerd worden dan op zeeniveau, omdat de straling dan minder afstand door de atmosfeer moet afleggen. Aan het aardoppervlak daarentegen is het grootste deel van de kosmische straling al door de atmosfeer erboven gestopt en wordt er dus het minste kosmische straling waargenomen.
Aan kosmische stralen is moeilijk te ontkomen en ze zijn ook een bron van ergernis voor vele wetenschappers. Soms is het nodig om zeer zwakke hoeveelheden straling van een radioactieve bron te kunnen meten. Dit kan bijvoorbeeld het geval zijn bij het bestuderen van zeer zwakke en ver van ons verwijderde bronnen van gammastraling die slechts een zeer kleine hoeveelheid straling uitzenden in onze richting, of bij het bestuderen van de uitdijing van het heelal waarbij we de erg zwakke zogenaamde microgolf-achtergrondstraling (die het restant is van de Big Bang waarmee het heelal ontstaan is en die overal in het heelal aanwezig is) willen meten. .

Terwijl rivieren doorheen het landschap over rotsen en over de bodem stromen, dragen ze allerlei in het water opgeloste mineralen met zich mee. Na verloop van tijd en naarmate het water verdampt door de warmte van de zon, neemt de concentratie van die mineralen toe. Omdat de meeste rotsen kleine hoeveelheden uranium bevatten, is het niet verassend dat er in het zeewater ook uranium houdende mineralen aanwezig zijn. Dit zorgt ervoor dat de zee lichtjes radioactief is, en niet alleen door de aanwezigheid van uranium, want er komen ook nog andere radioactieve stoffen in het zeewater voor, zoals 40K (uitgesproken als kalium-40 ). Deze vorm van kalium is de voornaamste stof die ervoor zorgt dat ons lichaam radioactief is. Gemiddeld bevat elke duizend liter zeewater (dit is 1 kubieke meter) ongeveer drie milligram uranium. Dit is misschien niet veel, maar als de kostprijs om uranium uit zeewater te halen zou kunnen verminderd worden tot één tiende van wat die nu is, zou het rendabel worden om uranium uit het zeewater te halen. Als de huidige uraniummijnen ooit zouden uitgeput raken, zouden onze kerncentrales dus nog steeds kunnen werken met uranium uit zeewater.
De lucht die we inademen bevat een kleine hoeveelheid radioactiviteit onder de vorm van koolstof, beter gekend als 14C (uitgesproken als koolstof-veertien); soms zal je 14C geschreven zien als koolstof-14). ). Koolstof-14 atomen zijn het resultaat van de botsing van kosmische straling met de atmosfeer. De kosmische straling ondergaat daarbij veel veranderingen, waarbij thermische (dit zijn trage) neutronen kunnen geproduceerd worden. Die reageren met de stikstof-14 atomen in de atmosfeer via een kernreactie waarbij koolstof-14 atomen geproduceerd worden. Die vormen dan op hun beurt (samen met zuurstofatomen) moleculen van koolstofmonoxide (CO) die door planten geabsorbeerd worden en door fotosynthese worden omgezet tot cellulose en suiker. Daarbij worden dus koolstof-14 atomen die in de koolstofmonoxide zitten door de planten opgenomen. Dit koolstof-14 wordt dan overgedragen aan ons, als we de planten eten of dieren eten die planten hebben opgegeten. Het feit dat alle levende organismen koolstof-14 atomen opnemen tot op het moment dat ze sterven, kan gebruikt worden om overblijfselen van deze organismen die misschien al honderden of duizenden jaren in de bodem hebben gezeten te dateren. Dit proces is gebaseerd op de halfwaardetijd van radioactieve atomen (dit is een maat voor de snelheid waarmee radioactieve atomen straling uitzenden en daarbij veranderen in een ander soort atoom (element)). Hier komen we later nog op terug.
Wanneer we planten eten (of dieren die planten hebben gegeten) krijgen we koolstof-14 atomen binnen, die radioactief zijn en straling uitzenden in ons lichaam. Het voedsel dat we elke dag tot ons nemen bevat verder ook ongeveer 2 tot 3 gram kalium. Dit betekent dat voor elke kilogram lichaamsgewicht er elke seconde ongeveer 50 kaliumatomen vervallen en radioactieve deeltjes uitzenden in ons lichaam. Daarnaast er ook nog zeer kleine hoeveelheden van andere radioactieve elementen in ons lichaam aanwezig, waaronder zelfs uranium. Als je bijvoorbeeld toevallig wat zeewater inslikt bij het zwemmen zal je een kleine hoeveelheid uranium opnemen, omdat al het zeewater uranium bevat. Dit is echter zo een minuscule hoeveelheid dat ze totaal ongevaarlijk is voor onze gezondheid.
We hebben al besproken hoe kosmische straling koolstof-14 atomen produceert dat wordt gebruikt om koolhydraten te produceren als ze door planten, en dus ook door dieren en door ons zelf worden opgenomen. Zo dringt koolstof-14 de voedselketen binnen en alle levende organismen worden er aan blootgesteld.
Een erg grote hoeveelheid (dit noemen we ‘dosis’) radioactiviteit kan dodelijk zijn. Duizenden mensen zijn gestorven door een te hoge dosis straling ten gevolge van de atoombommen die in 1945 op Japan gegooid werden. Recenter, in 1986, zijn er 31 mensen omgekomen door straling wanneer de kerncentrale in Tsjernobyl door een explosie werd vernield. Bij de ramp met de kerncentrale in Fukushima in maart 2011 is gelukkig niemand door straling omgekomen. In het hoofdstuk “Voordelen en Risico’s” en in het hoofdstuk “Geschiedenis” wordt hier dieper op in gegaan.
Atoombommen en het ongeval met de kerncentrale in Tsjernobyl waren echter zeer uitzonderlijke omstandigheden. De hoeveelheid straling die nodig is voor het schaden van de gezondheid is gelukkig zeer vele malen groter dan de achtergrondstraling die afkomstig is van bijvoorbeeld kosmische straling, rotsen enz. Als onze lichaamscellen worden beschadigd door straling kan ons lichaam die schade herstellen zolang er maar een beperkt aantal cellen beschadigd zijn. Bij hogere stralingsdoses worden meer cellen beschadigd en is ons lichaam niet altijd meer in staat om ze allemaal te herstellen. Dit is de reden waarom hoge stralingsdoses gevaarlijk kunnen zijn.
We weten dat planten en dieren al enkele miljarden jaren leven met radioactiviteit om zich heen en toch gunstig geëvolueerd zijn. Of straling gevaarlijk is hangt dus af van de ontvangen dosis. Zelfs een te grote hoeveelheid gewoon zout innemen kan dodelijk zijn voor een mens, en dat is waarom mensen die op de oceaan rondzwerven vaak omkomen van dorst! Zoals er vaak gezegd wordt, overdaad schaadt.
In de vorige paragraaf hebben we kort uitgelegd wat radioactiviteit is: het is het verval van een onstabiele atoomkern naar een ander soort atoomkern (van een ander element) waarbij straling wordt uitgezonden in de vorm van deeltjes (alfa- en bètastraling) of energiepakketjes (gammastraling). In de volgende paragrafen zullen we hier meer gedetailleerd op in gaan en leren wat maakt dat een atoomkern onstabiel, of radioactief, is en wat juist het verschil is tussen de verschillende soorten straling.
We weten al dat een atoom bestaat uit een atoomkern die zich in het centrum van het atoom bevindt en die protonen en neutronen bevat, en elektronen die rond die atoomkern draaien. We weten ook dat atomen normaal gezien elektrisch neutraal zijn, terwijl ionen, dat zijn atomen die elektronen hebben bijgekregen of verloren hebben, elektrisch geladen zijn (negatief of positief). Om te begrijpen wat radioactiviteit juist is moeten we nu eerst uitleggen wat isotopes zijn.
We hebben al gesproken over koolstof-14 dat radioactief is, terwijl het gewone koolstof-12 dat niet is. Waarin verschilt koolstof-14 dan van koolstof-12? Het verschil zit in hun atoomkernen. Om allebei atomen van het element koolstof te zijn moeten ze hetzelfde aantal protonen in hun kern hebben. We zeggen dan dat ze hetzelfde atoomnummer hebben (6 voor koolstof). Het aantal protonen in de atoomkern, of dus het atoomnummer, onderscheidt de verschillende elementen dus van elkaar. Als we het aantal elektronen die rond de kern draaien, veranderen, maken we van het atoom een ion, maar het blijft van hetzelfde element. Het verschil tussen koolstof-14 en koolstof-12 moet dus zitten in het aantal neutronen in hun kern (8 voor koolstof-14 en 6 voor koolstof-12). We zeggen dan dat koolstof-14 en koolstof-12 (met eenzelfde aantal protonen, maar een verschillend aantal neutronen in hun kern) twee “isotopen” zijn van het element koolstof. Isotopen van eenzelfde element hebben door het verschillend aantal neutronen in de kern dus ook een verschillende massa (14 versus 12 in dit geval).
Elk element heeft dus meerdere, en soms wel heel veel, isotopen. Het element tin bijvoorbeeld heeft meer dan 20 isotopen. Een ander voorbeeld is deuterium, een stabiele isotoop van het element waterstof, met één proton en één neutron in zijn kern (de kern van gewoon waterstof bevat alleen maar één enkel proton). Het isotoop deuterium kan worden gebruikt om ‘zwaar water’ te maken (water waarbij de twee waterstofatomen in elk molecuul vervangen zijn door twee deuteriumatomen) dat een aantal interessante toepassingen heeft, zoals voor de detectie van neutrino’s en het vertragen van de neutronen die bij de splijting van uranium in kernreactoren vrijkomen.
Een aantal onstabiele isotopen zijn erg nuttig in de geneeskunde (voor diagnose of om kankergezwellen te bestralen in de hoop ze zo te vernietigen) en kunnen zonder verdere risico’s worden gebruikt omdat ze een korte levensduur hebben (d.w.z. maar een korte tijd radioactief blijven). Isotopen met dergelijke korte levensduren worden echter niet zomaar op aarde aangetroffen. Ze moeten daarom in de ziekenhuizen zelf worden geproduceerd met machines (deeltjesversnellers) die we cyclotrons noemen. Er bestaan cyclotrons van verschillende afmetingen, afhankelijk van waar ze voor moeten dienen en welke radioactieve isotopen ermee moeten geproduceerd worden. In zo een cyclotron worden bepaalde deeltjes (meestal protonen) met behulp van magneten en sterke elektrische velden in een cirkelbaan gehouden en tot hoge energie versneld. Daarna worden ze op een stilstaand plaatje geschoten waarin dan de radioactieve isotopen (soms ook wel kortweg “radioisotopen” genoemd) worden geproduceerd.
De stabiele (niet-radioactieve) isotopen van de verschillende elementen zijn degene die we algemeen in de natuur aantreffen en die we ook vermelden in de Tabel van de Elementen (de Tabel van Mendeljev). Ze zijn echter alleen maar algemeen voorkomend omdat ze stabiel (dus niet radioactief) zijn. De radioactieve isotopen van de verschillende elementen zijn in de loop van de tijd al vervallen naar de meer stabiele isotopen, waardoor uiteindelijk alleen de stabiele isotopen overblijven. Maar waarom zijn sommige isotopen dan stabiel en andere dan weer niet? Dat zal in de volgende paragrafen aan bod worden.
Wanneer we de atoomkern voor het eerst besproken hebben, hebben we even vermeld dat de nucleonen (protonen en neutronen) in de atoomkern worden samengehouden door de sterke kernkracht, die sterk genoeg is om de elektrostatische afstoting van de protonen in de kern tegen te gaan. Dit is cruciaal om te begrijpen of een atoomkern stabiel is of niet. Zowel de protonen als de neutronen in de kern voelen de sterke kernkracht, maar alleen de protonen stoten elkaar af. De neutronen versterken de kracht waardoor de protonen en de neutronen in de kern worden samen gehouden, zonder daarbij echter bij te dragen aan de elektrostatische afstoting.
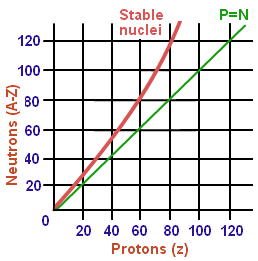
Op basis van wat we zonet besproken hebben zou je kunnen denken dat een atoomkern meer stabiel wordt naarmate er meer neutronen in zitten. Atoomkernen blijken echter alleen maar stabiel te zijn zolang de verhouding van het aantal neutronen en protonen zich binnen welbepaalde grenzen bevindt, namelijk tussen ongeveer 1 en 1.6. Voor lagere en hogere waarden van deze verhouding is de atoomkern onstabiel en zal dus vervallen. Het lichte isotoop stikstof-14 bijvoorbeeld heeft een neutron/proton-verhouding van 1 (namelijk 7 protonen en 7 neutronen) en is dus stabiel. Bij de zware elementen bevat het stabiele isotoop van het element lood, namelijk lood-208, in totaal 82 protonen en 126 neutronen, en is de neutron/proton-verhouding dus 1.54. De figuur toont het gebied van de stabiele kernen in functie van het aantal protonen en neutronen.
Een heel belangrijk begrip in de kernfysica is de bindingsenergie. Er zijn verschillende soorten bindingsenergie, maar voor onze doeleinden kijken we enkel naar de nucleaire bindingsenergie. Dit is de hoeveelheid energie die aan de atoomkern moet toegevoegd worden om alle nucleonen terug uit elkaar te halen. De bindingsenergie van de hele atoomkern is lager dan van de som van de afzonderlijke kerndeeltjes, wat dus een andere manier is waarop de atoomkern wordt samengehouden. Het is energetisch gunstiger (m.a.w. het kost minder energie, de energie is lager) voor nucleonen om een atoomkern te vormen en in deze toestand samen te blijven in plaats van te scheiden. Een belangrijk begrip in deze context is de bindingsenergie per kerndeeltje (per nucleon dus).
Er is en bovengrens voor de massa van een atoomkern. Bij zware kernen is de sterke kernkracht namelijk niet langer in staat om de buitenste nucleonen (protonen en neutronen) vast te houden. De grootste gekende tamelijk stabiele atoomkern is die van uranium, die 238 nucleonen bevat. Toch is ook deze atoomkern niet volledig stabiel, want we weten dat uranium radioactief is, zodat het uiteindelijk radioactief zal vervallen, vooral door alfaverval. Dat duurt echter wel een lange tijd, ongeveer 4.5 miljard jaar.
Bij alfaverval wordt een alfadeeltje of heliumkern uit de kern van het atoom gestoten. Dit verlies van massa helpt de atoomkern om een meer stabiele toestand te bereiken. Een atoomkern die een alfadeeltje uitzendt verliest vier nucleonen, twee protonen en twee neutronen, en ondergaat tegelijk transmutatie (verandert dus naar een ander element) omdat hij twee protonen verliest. Het zijn deze alfadeeltjes die Rutherford gebruikte in zijn verstrooiingsexperimenten waarmee hij atomen bestudeerde.
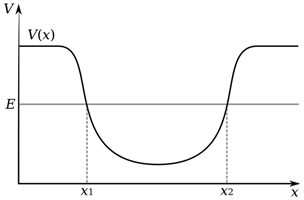
Zoals al gezegd, leidt alfaverval tot een afname van de massa van de atoomkern. Dit is echter alleen mogelijk wanneer de bindingsenergie per nucleon zich niet op zijn minimumniveau bevindt. Alfaverval wordt daardoor alleen waargenomen voor de zwaarste atoomkernen van de elementen vanaf tellurium en zwaarder. Alfaverval is een voorbeeld van een proces dat “tunneling” genoemd wordt. Laat ons dat even verder uitleggen. De kern van een atoom creëert een potentiaalput (een minimum in potentiële energie), zoals aangegeven in de figuur, die het alfadeeltje dat binnen in de atoomkern al bestaat, gevangen houdt.
Een belangrijk kenmerk om de verschillende soorten straling van elkaar te onderscheiden is hoe diep ze in een materiaal kunnen doordringen. Doordat alfadeeltjes relatief traag zijn, maar ook omdat ze een relatief grote lading en grote massa hebben, zullen zij op hun weg door de materie zeer veel botsen met andere deeltjes. Hierdoor kunnen alfadeeltjes maar door een paar centimeter lucht bewegen, en worden ze al gestopt in een dun vel papier of een dun plaatje van aluminium. Ze raken ook niet door de bovenste, dode laag van onze huid, de opperhuid.
Er bestaan veel materialen (radioactieve bronnen) die alfadeeltjes uitzenden. Uranium is één van de meest bekende ervan. Een uraniumkern vervalt door de uitzending van een alfadeeltje (α) en verandert (transmuteert) daardoor naar thorium. Dit is slechts de eerste stap in het vervalproces van uranium. Zoals we verder nog zullen zien, zijn er veel meer stappen nodig voordat uranium helemaal stabiel wordt. De kernreactie voor het verval van uranium naar thorium wordt weergegeven in de vergelijking: :
238U → 234Th + α
Dit is maar de eerste stap in het verval van uranium dat nog door een reeks andere vervalprocessen moet vooraleer het volledig stabiel (niet-radioactief) wordt. Het alfadeeltje (α) is eigenlijk een heliumatoomkern of een helium 2+ ion, dus een heliumatoom dat twee elektronen verloren heeft waardoor het niet meer neutraal is en een lading 2+ krijgt.