Quizá hayas oído hablar de algo denominado elemento. Todos los materiales que nos rodean en la vida diaria, incluyendo los tejidos y los huesos de nuestro propio cuerpo están constituidos por esos elementos y algo sorprendente es que su número total es pequeño.
¿Qué hace que un elemento sea diferente de otro?
Esta pregunta podremos responderla mejor cuando hablemos sobre la estructura de los átomos con mayor
detalle. Los elementos se diferencian entre sí a escala atómica. Por ejemplo el oro tiene propiedades
distintas a las del magnesio porque los átomos individuales del material tienen estructuras ligeramente
diferentes. Estas diferencias pueden afectar las propiedades físicas, como su apariencia (el oro es brillante,
duro y amarillo, mientras el magnesio es plateado y más flexible). Pero lo mas importante es que sus
propiedades químicas también son muy diferentes, o sea como interactúan con otras sustancias (el oro es muy
inactivo químicamente, sin embargo el magnesio reacciona inmediatamente con el agua). Sus diferencias
estructurales también determinan como se combinan con otros elementos.
Existe una tabla muy útil, la tabla periódica, que ordena los elementos de acuerdo con su estructura atómica
y consecuentemente con sus propiedades. Esto también lo explicaremos con más detalle más adelante.
Los elementos que constituyen todo lo que nos rodea se encuentran en la naturaleza. Entonces, ¿de dónde viene todo el carbono del que estamos hechos? Todos los elementos estables que encontramos a nuestro alrededor se originaron mucho mas allá de nuestro planeta tierra, en el espacio. Los elementos ligeros hasta el hierro se produjeron en un proceso llamado núcleo-síntesis en los núcleos de las estrellas. Elementos más allá del hierro se producen en procesos violentos (explosiones de supernova) que tienen lugar en estrellas moribundas. Ambos procesos se explicarán también más adelante. Pero esto quizá ya te de una pista de por qué hay más carbono que oro en el universo, ya que sólo las estrellas más masivas pueden crear elementos más pesados como el oro y convertirse en supernovas.
Las primeras teorías relativas a la existencia de los átomos se remontan a la antigua Grecia, cuando el
filósofo Demócrito se percató de que llegaría el momento en el cual el pan que tenia entre sus manos no se
podría cortar en pedazos más pequeños: sería indivisible. Él sugirió que toda materia debía estar constituida
por bloques fundamentales indivisibles, que no pueden destruirse, y a los cuales llamó átomos, que en griego
significa indivisibles (o imposibles de cortar).
Sin embargo, la idea moderna de los átomos surgió con la química. John Dalton observó que 8 gramos de oxígeno
siempre se combinan exactamente con un 1 gramo de nitrógeno. Así surgió la teoría de que a escala muy pequeña,
un elemento se combina siempre con un cierto número de otros elementos y que este número es característico para
cada elemento. Esto permitió una evolución en el concepto de átomo. Pero si bien los químicos tuvieron la
idea fundamental de la existencia de los átomos, fueron los físicos los que dieron el siguiente paso al
desentrañar su composición.
El descubrimiento del núcleo
Una vez aceptada la idea de que los materiales tienen estructura a pequeña escala (escala atómica), los
científicos empezaron a teorizar sobre aquello que confería a los átomos sus propiedades, es decir, trataron
de encontrar la razón por la cual los átomos de oro de comportan de manera diferente a los de magnesio. Una
de las teorías con mayor aceptación fue la del modelo de la tarta de pasas. En él, el átomo estaba formado por un mar de
cargas positivas (la masa de la tarta) en las que se intercalaban cargas negativas (las pasas).
La cargas positivas y negativas se cancelaban mutuamente resultando un átomo eléctricamente neutro.
La primera evidencia de que la estructura de átomo era muy diferente a esta primera imagen se la debemos a
Rutherford. En un experimento realizado en 1911, Rutherford bombardeó una delgada lámina de oro (con un
espesor de tan sólo unos pocos átomos) con lo que se conocía como partículas alfa. Estas partículas están
cargadas positivamente y hoy sabemos que son núcleos de Helio. Rutherford observó que tras golpear los átomos,
sólo una pequeñísima cantidad de las partículas rebotaban y volvían hacia atrás, algunas sufrían pequeñas
desviaciones en su trayectoria, mientras que la mayoría de ellas atravesaban la lámina. Con todo esto
Rutherford concluyó que los átomos poseían un volumen muy pequeño en su centro cargado positivamente, y que
era el responsable de que las partículas alfa que inciden sobre él saliesen rebotadas. También se percató de
que la mayoría del átomo estaba vacío, así las partículas alfa que incidían en esta zona vacía atravesaban la
lámina sin desviarse. Por último, las partículas que se desviaban ligeramente lo hacían por repulsión
eléctrica entre cargas iguales y se correspondían con aquellas que pasaban cerca de la carga positiva del
centro.
El nuevo modelo de Rutherford consistía en una ínfima esfera de carga positiva localizada en el centro del
átomo a la que denominó núcleo. Para garantizar que el átomo fuera neutro, los electrones, cargados
negativamente orbitaban alrededor del núcleo de forma similar a las órbitas que describen los planetas. Este
modelo se aceptó como válido hasta que experimentos mas recientes basados en principios cuánticos demostraron
que no era completamente correcto.
El núcleo
Los físicos nucleares trabajan para desentrañar el comportamiento del núcleo atómico. En esta tarea, es
fundamental comprender su estructura a escalas muy pequeñas. El descubrimiento de los electrones es anterior
al del núcleo y se debe a J Thomson que demostró que los rayos catódicos eran en realidad partículas cargadas
negativamente. Posteriormente, Millikan determinó de manera precisa su relación carga/masa en un experimento
realizado con gotas de aceite cargadas.
Anteriormente al experimento de Rutherford se creía que todos los átomos estaban hechos a partir de átomos de
hidrógeno. En 1917, Rutherford realizó una experiencia en la que lanzó
partículas alfa sobre un gas de nitrógeno puro. En
sus detectores registró señales que se correspondían efectivamente con las producidas por átomos de hidrógeno
y su conclusión fue que éstos habían sido emitidos por los núcleos de nitrógeno como resultado de su colisión
con las partículas alfa. Su interpretación fue que el núcleo de nitrógeno contenía núcleos de hidrógeno o
protones. Es importante resaltar que ésta es la primera reacción nuclear registrada.
Llegado a este punto, los científicos desarrollaron los conceptos de masa y número atómico.
La masa atómica es la masa del átomo (hasta cierto punto podemos suponer que es la masa del núcleo puesto que
la masa de los electrones es muy pequeña en comparación y podemos despreciarla) y el número atómico es el
número de protones, o el número de electrones presentes en el átomo. La existencia del neutrón se introduce
mas tarde en 1920, precisamente para explicar la diferencia entre el número atómico y la masa atómica de un
núcleo. En 1932, James Chadwick demostró la existencia de un tipo de radiación, que originalmente se creía
eran partículas gamma, se debía en realidad a partículas neutras pero dotadas de una masa similar a la de los
protones. Estas partículas se llamaron neutrones.
El termino colectivo que se utiliza para denominar protones y neutrones, ambos constituyentes del núcleo, es
el de nucleones. Los nucleones se mantienen ligados por efecto de la fuerza fuerte, que es una de las cuatro
fuerzas fundamentales del universo. Esta fuerza es aproximadamente unas 1038 veces mas intensa que la
fuerza de la gravedad y solo actúa a muy corta distancia, del orden de 10-15 m, siendo capaz de
superar la repulsión electrostática que existe entre los protones del núcleo.
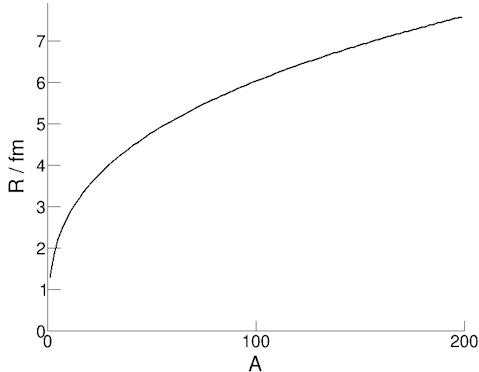
El radio de un núcleo puede determinarse a partir del estudio de la dispersión elástica de electrones,
interpretando el patrón de difracción resultante. Esta determinación experimental es más precisa que la
estimación que puede realizarse aplicando la conservación de momento.
R = r0 A1/3
En esta ecuación R es el radio nuclear, A el número de nucleones y la constante r0 el radio del nucleón ≈ 1.3 fm.