
En 1896, Henri Becquerel descubrió una nueva y misteriosa radiación. A diferencia de los rayos X , que desaparecían al apagar el tubo de rayos X, esta nueva radiación observada en el uranio se emitía continuamente. Más adelante, estudios realizados por Pierre y Marie Curie revelaron que otros elementos tenían la misma propiedad. En particular encontraron estas características en el polonio y el radio, en 1898.

Pierre y Marie Curie encontraron rápidamente un uso de esta propiedad y el radio se utilizaba en los hospitales ya en 1901. Se estableció que la radiación emitida por el radio tiene efectos beneficiosos en muchas enfermedades de la piel, incluyendo el cáncer.
Pierre y Marie Curie en su laboratorio, Paris 1898.
Esta nueva radiación es de origen nuclear. Algunos núcleos emiten espontáneamente partículas α (núcleos de helio), partículas β - que pueden ser electrones (β-) o positrones (β+) - y/o rayos γ (gamma) (es decir, fotones de alta energía). Estos núcleos inestables, caracterizados por un exceso de energía, se denominan radionúclidos o núcleos radiactivos, también conocidos como radioisótopos o isótopos radiactivos.
Ejemplos de radioisótopos naturales son el 238U (uranio), 40K (potasio), 232Th (torio) y sus núcleos hijos (obtenidos por decaimiento radiactivo de los anteriores) 226Ra (radio), 222Rn (radón) y 218Po (polonio). Otros radioisótopos naturales se producen continuamente por la acción de los rayos cósmicos en las capas superiores de la atmósfera, como, por ejemplo, 14C (carbono), 3H (tritio) y 7Be (berilio).
Irene y Frederic Joliot-Curie fueron los primeros en producir radioisótopos artificiales en 1933. Utilizaron una fuente α natural para bombardear aluminio-27, produciendo así radionúclidos de fósforo-30 que, a su vez, decaen mediante emisión β+ a silicio-30.
Desde entonces se han producido muchos nuevos radioisótopos, que han hecho posibles numerosas aplicaciones y han conducido a una mejor comprensión de la materia nuclear y las fuerzas nucleares. Para 1936 se habían producido unos 200 radionúclidos artificiales. Hoy se conocen aproximadamente 2.500. Se producen utilizando haces energéticos de iones, que van desde protones hasta 238U, empleando para ello aceleradores de partículas (principalmente ciclotrones o aceleradores lineales).
El primer acelerador, un ciclotrón, fue construido por Ernest O. Lawrence en Berkeley, EEUU, en 1932. Él y su hermano John Lawrence, que era médico, pronto encontraron aplicaciones médicas muy importantes y produjeron isótopos radiactivos para investigación biológica y médica, así como para el tratamiento de cánceres. El primer ciclotrón europeo fue construido por Frederic Joliot en el Colegio de Francia, París,1939.
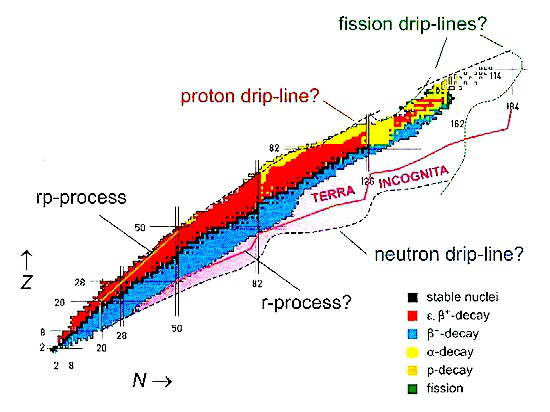
Los físicos van produciendo muchos nuevos isótopos, cada vez más y más lejos del valle de estabilidad nuclear. En la actualidad hay numerosas instalaciones con aceleradores que emplean haces de iones radiactivos para investigación. En lo que respecta a aplicaciones médicas la demanda de radioisótopos es un fenómeno mundial, y en los países desarrollados ha ido creciendo de manera exponencial desde 1995.
El premio Nobel de Química de 1943 fue otorgado a G. de Hevesy por ser el primero que utilizó elementos radiactivos naturales (y más tarde artificiales) como trazadores para estudiar elementos estables en sistemas biológicos. Una cantidad muy pequeña de un elemento radiactivo puede ser fácilmente seguida en el cuerpo humano. Esto también se puede lograr con trazadores químicos, pero sería necesario emplear cantidades mucho más grandes de compuestos químicos, lo que hace el procedimiento mucho más arriesgado para el paciente.
En una investigación típica de medicina nuclear, se administra un trazador radiactivo al paciente y los rayos γ emitidos por este radiotrazador se registran con una matriz de detectores de radiación. Esto se conoce como tomografía por emisión. Como trazador se elige generalmente un elemento que se deposita selectivamente en un órgano particular, de forma que los rayos γ detectados proporcionan una imagen detallada de la región de interés. Para el ojo entrenado, esas imágenes pueden revelar anormalidades estructurales o metabólicas que conducen a mejores diagnósticos. En medicina nuclear se emplea una gran variedad de isótopos, cada uno especialmente indicado para uno o varios órganos concretos del cuerpo humano.
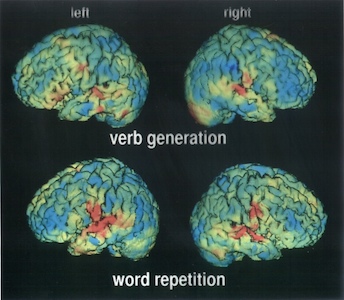
Es posible localizar tumores mediante técnicas como la Tomografía Computarizada por Emisión de Fotones Únicos (SPECT) o la Tomografía por Emisión de Positrones (PET) (en esta última, se utilizan núcleos emisores de positrones (β+) para producir - a través del proceso de aniquilación de pares - rayos γ energéticos). Las técnicas SPECT y PET son estándar en el diagnóstico de tumores, así como en estudios funcionales del cerebro.
Entre los elementos radioactivos, el yodo (I) juega un papel excepcional debido a que se liga al tejido del tiroides con gran afinidad y selectividad. En dosis reducidas el yodo se puede usar con propósitos diagnósticos. Alternativamente la radiación emitida por yodo radiactivo (ligado exclusivamente a sus tejidos) puede usarse para tratar el cáncer de tiroides.
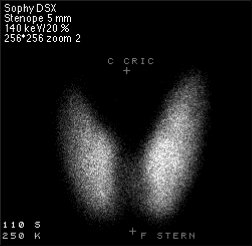
Desde el punto de vista fisiológico los elementos químicos más interesantes como el C (carbono), N (nitrógeno) y O (oxígeno) tienen isótopos emisores β+ de vida media corta, que se usan en la técnica PET (tomografía por emisión de positrones) Los núclidos emisores beta más comúnmente utilizados son 11C, 13N, 15O y 18F (fluorina).
SPECT son las siglas en inglés de tomografía computerizada por emisión de fotones individuales (Single Photon Emission Computed Tomography). En esta técnica se hacen imágenes de los órganos midiendo la distribución de un radiotrazador previamente inyectado, mediante una "cámara" gamma conectada a un ordenador. La imagen SPECT conlleva la rotación de un conjunto de detectores gamma en torno al paciente para tomar medidas desde ángulos diferentes. Con esta técnica se trata de encontrar la distribución espacial y la concentración del radionúclido. En SPECT se emplean radioisótopos como 99mTc y 123I, en los que se emite un solo fotón γ (de energía 140 keV y 159 keV respectivamente).
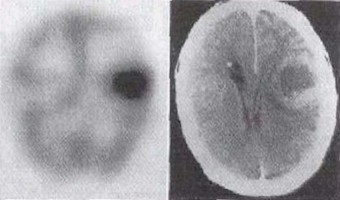
Existen muchas aplicaciones de la técnica SPECT tanto en imagen como en asistencia a la terapia. Escáneres SPECT de radioisótopos que no se absorban en los tejidos, sino que viajen en la corriente sanguínea pueden emplearse para observar cómo fluye la sangre a ciertos tejidos u órganos. Esto es particularmente útil para escanear el cerebro y el corazón.
En la técnica PET (tomografía por emission de positrons) se utilizan habitualmente 15O, 13N, 11C y 18F. Estos radioisótopos tienen períodos de semidesintegración de unos 2, 10, 20,4 y 110 minutos respectivamente, por lo que tienen que producirse cerca de donde se van a usar. Por eso, muchos hospitales tienen próximo un ciclotrón de pequeño tamaño construido para este fin, a veces en el propio centro hospitalario. El isótopo se liga a una substancia química como glucosa, agua o amonia, que se incorporan al cuerpo humano mediante una inyección o, en otros casos, por inhalación en forma gaseosa. El radioisótopo viaja a la parte del cuerpo que metaboliza la substancia a la que se ha ligado, lo que explica la gran variedad de substancias químicas que se utilizan en PET.
Las llamadas partículas elementales tienen sus antipartículas correspondientes. Una antipartícula es en esencia la misma partícula, con las mismas propiedades, excepto la carga, que es la opuesta. Cuando una partícula colisiona con su antipartícula se aniquilan emitiendo energía.
Los isótopos usados en PET son emisores β+, esto es, que se desintegran emitiendo positrones (e+). Tras ser emitidos, los positrones realizan un recorrido muy pequeño en el tejido, típicamente menor que 1 mm (aunque esto varía de isótopo a isótopo) y acaban aniquilándose con un electrón del medio (e-). La energía liberada en la aniquilación toma la forma de un par de fotones gamma (γ) emitidos en 180°, y con energía de 511 keV cada uno. La detección de dos rayos γ de manera simultánea (en coincidencia) en dos detectores, permite localizar la desintegración en la línea que los conecta.
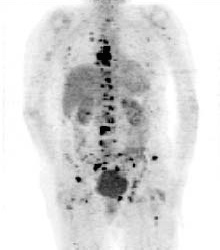
Habitualmente los escáneres PET se emplean en el diagnóstico del cáncer, de enfermedades coronarias y de algunos desórdenes cerebrales como la epilepsia y la enfermedad de Alzheimer. La técnica PET se usa también en la evaluación de la respuesta a la terapia tumoral. Además, los escáneres PET se usan en investigación, por ejemplo en estudios de los efectos del abuso de drogas sobre el envejecimiento.
Los riesgos asociados a una imagen PET son muy pequeños, pero como la mayoría de escáneres no siempre son adecuados para mujeres embarazadas o en período de lactancia. Dada la presencia de substancias radiactivas en el cuerpo, los hospitales recomiendan a los pacientes no tener contacto con embarazadas o niños pequeños hasta transcurridas unas horas después de un escáner PET.
A la izquierda se muestra una imagen de escáner PET que revela cáncer de hueso en el esqueleto (Hospital Erasmo de Bruselas).La imagen por SPECT es inferior a la PET en cuanto a la resolución y sensibilidad que se puede obtener. Mientras que para PET la mejor resolución espacial en humanos que se puede alcanzar es de unos 5 mm, para SPECT es 2 o 3 veces peor. Como se ha mencionado, debido a su rápida desintegración, la mayoría isótopos PET tienen que ser fabricados en las propias instalaciones, con la excepción de 18F con período de semidesintegración de 110 min. Por el contrario los isótopos SPECT como el 123I tienen un período de vida suficientemente largo (13,2 h) como para sea posible producirlos de manera centralizada en centros a tal efecto, y distribuidos por correo exprés. Esta diferencia entre PET y SPECT se va diluyendo con la introducción de nuevos isótopos PET, con períodos de vida mayores, que pueden ser producidos directamente o mediante generadores en los propios hospitales.
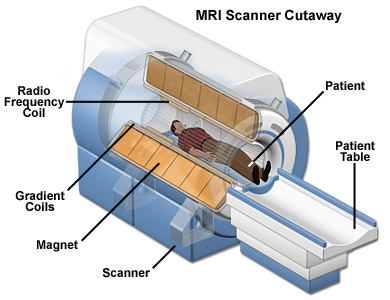
La principal ventaja de la IRM es que es no utiliza radiación ionizante. Las resonancias magnéticas muestran esencialmente la distribución de agua (H2O) en el organismo. El aparato consta básicamente de un tubo grande con potentes imanes en su interior. Cuando se aplica un campo magnético alrededor del paciente (que no es perjudicial para éste) los momentos magnéticos de los protones (núcleos de hidrógeno) en el agua se orientan en la dirección del campo magnético. Cuando éstos se relajan a su posición original se emiten ondas de radiofrecuencia que el escáner de resonancia magnética puede detectar y medir para hacer una imagen 2D del cuerpo. Las imágenes por RM se utilizan comúnmente para diagnósticos cerebrales o del corazón, pero se puede utilizar para casi cualquier parte del cuerpo.
La tecnología de resonancia magnética está en continuo desarrollo para hacer frente a una gama más amplia de problemas de diagnóstico clínico. Por ejemplo, se puede utilizar Xe-129 o He-3 polarizado para obtener imágenes de las vías aéreas en los pulmones con alta resolución espacial y temporal.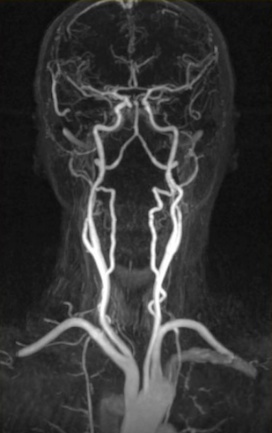
En 2003 se otorgó el Premio Nobel de Medicina a Paul Lauterbur y Sir Peter Mansfield por su trabajo y contribución a la imagen por resonancia magnética.
La mayoría de los hospitales modernos de hoy en día emplean resonancia magnética y PET, junto con otras técnicas de imagen. En muchos institutos de física nuclear existen grupos cuyas actividades y proyectos de investigación están dedicados al mismo tiempo a desarrollos de aplicaciones médicas específicas y al tratamiento del paciente. Entre ellos se pueden citar por ejemplo el GSI (Alemania), la ISP (Suiza), GANIL (Francia), HMI (Alemania) o LARN ( Bélgica).La hadronterapia es un tipo de radioterapia en la que se bombardea al tumor con partículas hadrónicas (en general compuestas de neutrones y protones). El daño producido por estas partículas en el ADN celular es indiscriminado. Sin embargo, las células cancerosas son en general menos capaces de repararse a sí mismas que las células sanas y se ven por tanto más afectadas.
Las partículas utilizadas en este tipo de terapia incluyen neutrones, protones e iones. Cada tipo de partícula tiene una característica (masa, carga) diferente. Todo ello, unido a las distintas energías a las que se pueden obtener, determina tanto su penetración en el cuerpo humano como la forma en que van depositando esta energía en su recorrido. El tipo más común de hadronterapia es la terapia con protones.
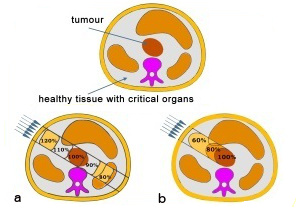
Un problema fundamental de todo tipo de radioterapia es la necesidad de maximizar la dosis administrada dentro al tumor y reducir al mínimo el daño al tejido sano que lo rodea. En las radiaciones electromagnéticas (rayos X o rayos γ) en general, hay una fracción apreciable de la dosis que se deposita en el tejido sano cercano al tumor.
La terapia con haces de protones u otros iones más pesados implica una mejora respecto a la radioterapia convencional con rayos X debido, entre otros factores, a la forma de deposición de dosis de estas partículas al penetrar en el tejido, que presenta un máximo al final de su recorrido. La terapia con haces de iones permite depositar en el tumor una dosis mayor y más eficaz que cualquier otro tipo de terapia externa.La imagen superior derecha muestra una comparación de los dos tipos de radioterapia. La terapia de fotones (a) deposita una dosis apreciable de radiación en el tejido sano frente y tras el tumor. En el caso de un haz de partículas (b), la mayor parte de la dosis se deposita en el tumor.
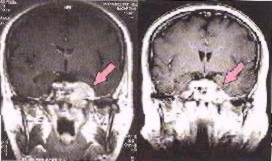
La figura izquierda muestra una imagen de un cáncer de cerebro antes y seis semanas después de la radioterapia con fotones e iones de carbono.
Hasta la fecha, más de 70 000 pacientes en todo el mundo han sido tratados con haces de protones. El tratamiento de los tumores oculares con haces de protones muestra con creces el mejor resultado clínico. La terapia con protones también está muy indicada cuando el tumor está cerca de un órgano crítico, ya que el primero puede ser atacado con gran precisión. Mientras mayor sea la conformidad entre el volumen irradiado y el volumen de destino (zona tumoral), mejores serán los resultados.
Todo lo dicho hasta ahora es válido para haces de iones pesados, con los que se puede conseguir una conformidad aún superior que con los protones. La terapia de iones pesados fue iniciada en 1974 en el Lawrence Berkeley Laboratory. Los primeros tratamientos de este tipo se realizaron con iones de Ar (argón) y más tarde, con Si (silicio) y Ne (neón). Los tumores irradiados estaban cerca de órganos críticos en el cerebro, la cabeza o el cuello. Los resultados fueron excelentes y motivaron la construcción de aceleradores de iones pesados especialmente dedicados a uso médico.
La braquiterapia es una forma de radioterapia en la que se introduce material radiactivo en el organismo, cerca del tumor. Las ventajas de este procedimiento son que la radiación no tiene que atravesar, desde el exterior del cuerpo, el tejido sano para alcanzar el tumor y en su lugar sólo afecta a un área localizada. Esto significa que se pueden administrar dosis relativamente altas con un riesgo menor. Además, el paciente no tiene que estar inmovilizado durante el tratamiento. Éste en general se completa antes que los de radioterapia externa y por tanto hay menos tiempo para que las células cancerosas se multipliquen.
La braquiterapia es una técnica estándar para algunos cánceres ginecológicos, tales como el cáncer de cuello de útero, de próstata y para ciertas etapas de carcinoma de cabeza y cuello. Para enfermedades de la próstata, se han utilizado diversos enfoques según el isótopo seleccionado. 125I (con una vida media de 60 días) y 103Pd (con vida media de 17 días) se utilizan para implantes permanentes. Estos isótopos pueden ser producidos por captura de neutrones en reactores. El 103Pd también puede ser producido de manera más eficiente en ciclotrones con haces de protones de 14 MeV. En los EE.UU. se tienen datos clínicos sobre la utilización en más de 10 años de 103Pd en la braquiterapia de próstata. Este éxito clínico, junto con la falta de efectos secundarios, ha hecho que sea una opción muy popular para este tipo de cáncer.
El Sol emite luz visible, radiación infrarroja que sentimos como calor y radiación ultravioleta que, por desgracia, puede ser peligrosa. La radiación ultravioleta puede causar melanoma de la piel (cáncer de piel). El melanoma de la piel es una de los cánceres más comunes y en 2008, por ejemplo, ha matado a unas 46.000 personas en todo el mundo.
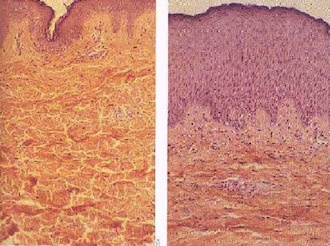
La tasa de diagnósticos de melanoma maligno se ha cuadruplicado en los últimos 30 años. Se encuentra más comúnmente en personas con antecedentes familiares de cáncer de piel, personas de piel y cabello claro y mayores de 40 años. Sin embargo, cualquier persona puede desarrollar cáncer sin importar la raza, la edad o la genética. La mayoría de los daños de la piel se producen antes de los 20 años, pero a menudo no se manifiestan hasta la edad de 40 años; de ahí que incluso si no se aprecian quemaduras solares, pueda estar dañándose la piel. Es por tanto muy importante usar protector solar y mantenerse fuera del sol cuando es más fuerte (11 a.m.-3 p.m.).
