
1896-ban Henri Becquerel egy új titokzatos sugárzást fedezett fel. A röntgen-sugárzással ellentétben, amely megszűnt a röntgencső kikapcsolásakor, ez az új sugárzás az urániumból folytonosan észlelhető volt. Pierre és Marie Curie feltárták, hogy más elemek is hasonló tulajdonsággal rendelkeznek. Ugyanilyen sugárzást mutattak ki a polónium és a rádium esetén 1898-ban.

Pierre és Marie Curie hamarosan gyakorlati alkalmazást is talált, a rádiumot a kórházakban már 1901-től használták. Felismerték, hogy a rádium sugárzása jótékony hatást fejt ki számos bőrproblémára, beleértve a rákos elváltozásokat is.
Pierre and Marie Curie a párizsi laboratóriumukban 1898-ban.
Az új sugárzás az atommagokból származik. Néhány atommag spontán módon kibocsáthat α-részecskéket (héliumatommagok), β-részecskéket, melyek lehetnek elektronok (β-) és pozitronok (β+), illetve γ-sugárzást (vagyis nagy energiájú fotonok). Az ilyen instabil, többletenergiával rendelkező atommagokat radionuklidnak, radioaktív nuklidnak, vagy radioizotópnak, radioaktív izotópnak nevezzük.
Természetes radioizotópok például a 238U (uránium), 40K (kálium), 232Th (tórium) és ezek leánymagjai a 226Ra (rádium), 222Rn (radon), 218Po (polónium). Radioizotópok, mint például a 14C (szén), 3H (trícium) or 7Be (berillium) a légkör felső rétegeiben is keletkeznek a kozmikus sugárzás hatására.
Irene and Frederic Joliot-Curie gyártotta az első mesterséges radioizotópot 1933-ban, amikor természetes α-forrással aluminium-27 izotópot sugároztak be, aminek hatására foszfor-30 radioizotóp keletkezett, amely β-bomlással a szilícium-30 atommagot hozta létre. A reakció során az alumíniumatommag egy protont vett át a héliumatommagtól (α-részecske).
Azóta számos más radioizotópot állítottak elő, ami új alkalmazások előtt nyitotta meg az utat és a maganyag illetve a nukleáris erők mélyebb megértését tette lehetővé. 1936-ra körülbelül 200 radionuklid vált ismertté. Ma nagyjából 2500 instabil nuklidról van tudomásunk. Ciklotronok és lineáris gyorsítóberendezések segítségével állítják elő őket, ahol részecskék, protonoktól az 238U-ig, nyalábját hozzák létre.
Az első gyorsítóberendezést (ciklotron) az egyesült államokbeli Berkeley-ben építette meg 1932-ben Ernest O. Lawrence. Ő és testvére, John Lawrence hamar felismerték a felgyorsított ionnyalábok orvosi alkalmazhatóságának lehetőségét, és radioaktív izotópokat gyártottak biológiai és orvosi kutatások céljából és a rákkezelések számára. Az első európai gyorsítót Frederic Joliot 1939-ben a párizsi College de France-ban alkotta meg.
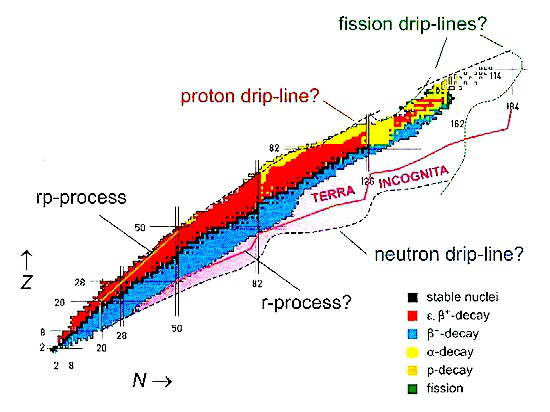
A fizikusok rengeteg új izotópot hoznak létre, amelyek egyre távolabb és távolabb vannak a természetes nukleáris stabilitási vonaltól. Jelenleg több olyan létesítmény is van a világon, amelyek radioaktív ionokat állítanak elő. Az orvosi radioizotópok iránti igény is folyamatosan nő világszerte, a növekedés a fejlődő országokban exponenciális 1995 óta.
1943-ban Hevesy Györgynek ítélték a Nobel-díjat azért, mert ő volt az első, aki természetes (és később mesterséges) radioaktív elemeket használt nyomjelzőként, hogy a biológiai rendszereket felépítő stabil elemeket tanulmányozzon. Már igen kis mennyiségű radioaktív anyag is könnyen követhető az emberi testben. Ez igaz a kémiai szerekre is, de jóval nagyobb mennyiséget kell alkalmazni, ami kockázatos a betegek szempontjából.
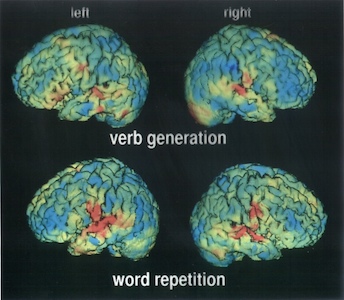
A tipikus nukleáris orvosi vizsgálatok során egy nyomjelzőt adnak be a betegnek, és a nyomjelző nuklid által kibocsátott γ-sugárzást figyelik egy sugárzást detektáló eszközrendszerrel. Ezt emissziós tomográfiának nevezik. A nyomjelzőt úgy választják meg, hogy az egy bizonyos szervben gyűljön fel, így a kérdéses területről részletes képet kaphatnak az orvosok. A gyakorlott szem egy ilyen képen a szerkezeti vagy az anyagcserével összefüggő rendellenességet képes felfedezni, ami nagymértékben segítheti a diagnózis felállítását. A nukleáris orvoslásban sokféle izotópot használnak, amelyek mindegyike egy-egy emberi szerv feltérképezésére a legalkalmasabb.
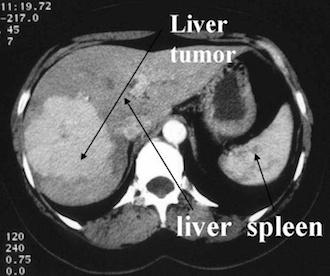
A fenti kép: PET alkalmazása a neurofiziológiában (az agy beszédközpontja), San Raffaele kórház, Milánó.
A rákos sejtek azonosíthatók az egyedi foton kibocsátáson alapuló számítógéppel vezérelt tomográfia (angolul Single Photon Emission Computed Tomography - SPECT) vagy a pozitronemissziós tomográfia (angolul Positron Emission Tomography - PET) segítségével. A SPECT és a PET technikák a rákdiagnosztikában és a normális egészséges agy vizsgálatában is standard eljárásnak számítanak.
Jód nyomjelző felhasználásával készített számítógép-vezérelt tomográfiás röntgenkép (Erasme kórház, Brüsszel)
A radioaktív elemek közül a jód (I) különleges szerepet játszik, mivel egyedi módon csak a pajzsmirigy szöveteihez kapcsolódik. Alacsony dózisban diagnoszikára, és besugárzással pedig a pajzsmirigy-rák kezelésére lehet használni.
Az testműködés szempontjából legérdekesebb kémiai elemeknek (szén - C, nitrogén - N, oxigén - O) β+-sugárzással bomló izotópjait a PET technikában alkalmazzák. A legismertebb ilyen béta-bomló atommagok a 11C, 13N, 15O és 18F (fluor).
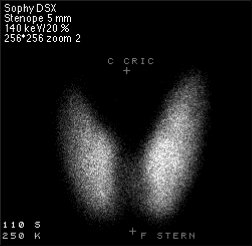
Jobboldali kép: Technécium felhasználásával pajzsmirigyről készített szcintigráfiás kép.
A SPECT az egyedi foton kibocsátáson alapuló számítógéppel vezérelt tomográfia kifejezés angol megfelelőjének (Single Photon Emission Computed Tomography) a rövidítése. Az eljárás során a szervekről úgy készítenek felvételt, hogy a páciensbe juttatott radioaktív nyomjelző eloszlását térképezik fel egy gamma-kamerával, amely egy számítógéphez csatlakozik. A képalkotáskor a gamma-detektorrendszert a beteg körül mozgatják, hogy minden irányból begyűjtsék az információt. Ezzel a technikával a radionuklid térbeli és koncentrációeloszlását mérik. A SPECT eljárásban általában a 99mTc-et vagy a 123I-at használják, amely izotópok egy meghatározott energiájú gamma-fotont bocsátanak ki.
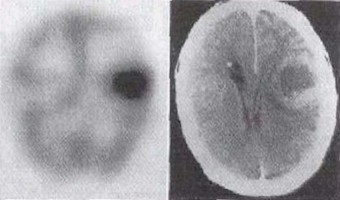
A terápiás kezelésekkor és kezelésekben is gyakori a SPECT alkalmazása. Az olyan radioizotópok segítségével, amelyek nem nyelődnek el a szövetkben a véráramot lehet tanulányozni bizonyos szövetekben és szervekben. Ez különösen fontos az agy és a szív ereinek feltérképezésében.
A pozitronemissziós tomográfia (PET) során a leggyakrabban a 15O, 13N, 11C és 18F izotópokat alkalmazzák. Mivel ezeknek a radioizotópoknak nagyon rövid az élettartama, rendre 2 perc, 10 perc, 20,4 perc és 110 perc, a felhasználáshoz közel kell őket gyártani. Ezért sok kórházhoz közel vagy éppen az intézeten belül kell lennie egy kis ciklotronnak, amely képes ezeknek az izotópoknak az előállítására. Az elkészített izotópokat kémai eljárással cukorhoz, vízhez vagy ammóniához kötik, amely anyagokat már a betegekbe lehet juttatni injekció vagy inhalálás segítségével. A radioizotóp a testnek arra a részére kerül, ahova az adott kémiai anyag kötődni tud, ezért különféle anyagokat használnak szállítóként.
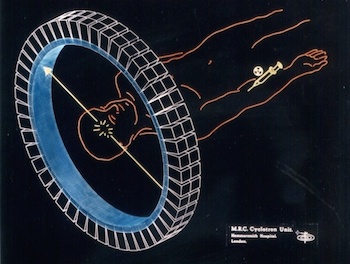
Az elemi részecskéknek mindig van antirészecske párjuk. Az antirészecske tulajdonképpen a részecskéhez nagyon hasonló, csak ellentétes tulajdonságokkal rendelkezik (például ellentétes töltéssel). Amikor egy részecske és egy antirészecske találkozik, akkor mindkettő megsemmisül, és pusztán energia keletkezik.
A PET képalkotás során tipikusan β+-bomló izotópokat használnak. Amikor az izotóp elbomlik a beteg testében a kibocsátott pozitron (β+) csak nagyon rövid utat tesz meg (kevesebb, mint 1mm, az izotóptól függően) mielőtt egy elektronnal (β-) találkozva megsemmisül. Az energia két 511keV energiájú gamma-foton (γ) formájában kerül kibocsátásra, amelyek az megsemmisülési pontból ellentétesen, egymáshoz képest 180°-ban távoznak. A két foton egyidejű detektálása lehetővé teszi a kibocsátási pont meghatározását.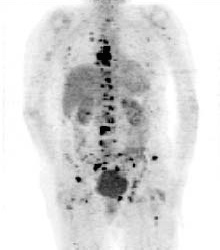
A PET technika többnyire a rákdiagnosztikában, a szívműködés vizsgálatában és bizonyos agyi rendellenességek (epilepszia, Alzheimer-kór) megállapításában a leghatékonyabb. A PET-et a rákkezelés hatékonyságának vizsgálatára is alkalmazzák. Továbbá a PET eljárás segíthet olyan kutatásokban, amelyek a drogfüggőség és öregedés hátterét próbálják feltárni.
A PET vizsgálatokkal járó kockázat nagyon alacsony, azonban, mint ahogyan más képalkotási eljárások esetén is, a terhes és szoptató nőknek nem feltétlen ajánlott. Mivel a betegek testében a kezelések után radioaktív anyag marad, terhes nőkkel illetve kisgyerekekkel történő közvetlen érintkezés néhány óráig nem tanácsos.
Csontrákot feltáró PET (Erasme kórház, Brüsszel).A SPECT feloldása és érzékenysége rosszabb a PET-nél. A PET térbeli felbontóképessége jelenleg 6 mm körül van, amely 2-3-szor jobb, mint a SPECT-nél elérhető érték. A gyors bomlás miatt a PET-nél alkalmazott izotópokat, a 18F kivételével (110 perces felezési idő), a felhasználás helyén kell előállítani. A SPECT-nél használt izotópokat, például 123I (13,2 óra felezési idő), amelyek megfelelően hosszú felezési idővel rendelkeznek, egy központi helyen is lehet gyártani, majd gyorspostával a felhasználás helyére szállítani.
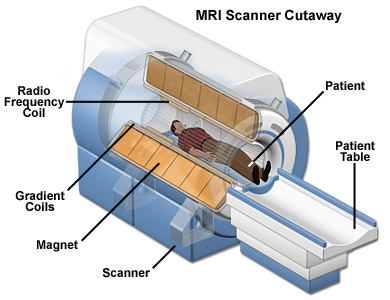
Az MRI nagy előnye, hogy nem használ radioaktív anyagot. Az MRI a víz (H2O) és ezáltal az azt tartalmazó szervek eloszlását térképezi fel. Az MRI tulajdonképpen egy hatalmas cső tele nagyon erős mágnesekkel. A beteg körül fellépő mágneses tér (amely veszélytelen) hatására a vízben lévő protonok (hidrogénatommagok) egy irányba állnak. Amikor a protonok visszafordulnak az eredeti helyükre, rádióhullámok keletkeznek, amelyeket detektálni lehet és a test kétdimenziós képét el lehet készíteni. Az MRI-ket többnyire agyi és szívproblémák esetén alkalmazzák, de lényegében a test bármely részéről készíthető felvétel.
Az MRI technológiát továbbfejlesztették, így más orvosi diagnosztikai problémák esetén is bevethető. Például polarizált Xe-129 vagy He-3 izotópok segítségével a tüdő légmozgásait lehet rendkívül jó térbeli és időbeli feloldással tanulmányozni.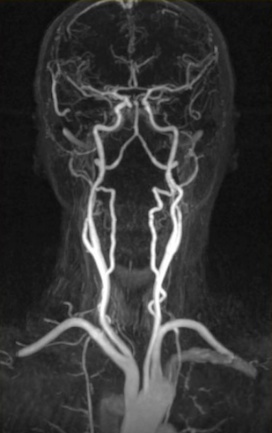
A 2003. évi orvosi Nobel-díjat Paul Lauterburnak és Sir Peter Mansfieldnek ítélték oda az MRI technikában kifejtett munkásságukért.
A legtöbb modern kórházban manapság van MRI és PET berendezés, és más képalkotási technikákra is nyílik lehetőség. Számos korábban csak magfizikával foglalkozó intézetben van már olyan csoport, amely tevékenysége és kutatásai a betegek érdekében történő orvosi alkalmazások tökéletesítésére és fejlesztésére irányul. Ilyen intézetek a GSI (Németország), PSI (Svájc), GANIL (Franciország), HMI (Németország) és LARN (Belgium).A sugárterápia lényege az, hogy ionizált részecskéket juttatunk a tumorra. Az ionizáció a sejtek DNS-ét válogatás nélkül károsítja. Azonban a rákos sejtek kevésbé képesek önmaguk megjavítására, ezért érzékenyebbek az ilyen roncsolásra.
Általában protonokat, neutronokat, vagy más, pozitívan töltött ionokat használnak lövedékként. Mivel a részecskék fajtája és energiája eltérő, az emberi testbe nem ugyanolyan mértékben képesek behatolni. Ezért a különböző eljárások során más-más részecsketípust alkalmaznak. A leggyakoribb a protonterápia.
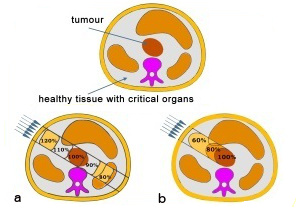
A sugárterápia alapproblémája az, hogy hogyan lehet maximalizálni a tumorra jutó dózist, miközben a környező egészséges sejteket minimális mértékben károsítjuk. Az elektromágneses sugárzások (röntgen és gamma) esetén a dózis nagy része a rákos terület előtt illetve után elhelyezkedő, egészséges szövetben nyelődik el.
A nagy energiájú részecskék alkalmazásával (p, nehézionok) a sugárterápia sokkal hatékonyabbá tehető, mert az ionok által átadott dózis a behatolási mélységgel növekszik és maximális értéket és el az út végén. Az ionnyaláb-terápia segítségével nagyobb és hatékonyabb dózis juttatható a tumorra, mint bármely más külső terápiával.A jobb felső képen a két eljárás összehasonlítását láthatjuk. A fotonterápia (a) nagy dózist ad le a tumor előtti egészséges szövetben. A részecskenyaláb esetén (b) a dózis nagy része a tumorra jut.
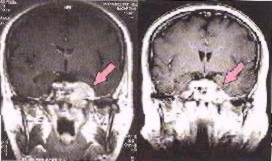
A baloldali képen fotonokat és szénionokat felhasználó radioterápia előtt és azután hat héttel, agyrákról készített felvételeket láthatunk.
Napjainkig kb. 50000 embert kezeltek a világon protonnyalábbal. A szemtumorok protonnyalábos kezelése szolgáltatta mindeddig a legjobb klinikai eredményeket. A protonterápia akkor is ideális, ha a tumor egy kritikus szervhez közel helyezkedik el, mivel a nyalábbal nagyon pontosan lehet célozni. Minél inkább egyezik a besugárzott és a céltérfogat, az eredmények annál jobbak. Ez a nehézionokra is igaz, ahol még a protonokhoz képest is sokkal jobb egyezés érhető el. A nehézionterápiát 1974-ben a Lawrence Berkeley laboratóriumban kezdték el. Az első kezeléseket Ar (argon) ionokkal végezték, majd később Si (szilícium) és Ne (neon) ionokat is alkalmaztak. A besugárzott rákos sejtek az agyban, a fejben és a nyakban elhelyezkedő kritikus területekhez közeliek voltak. Az eredmények kitűnőek voltak, amelynek hatására egy kifejezetten orvosi célokra szolgáló nehézion-gyorsító építésébe kezdtek.
A brachyterápia olyan sugárterápia, amelynek során a radioaktív anyagot egyből a testben lévő rákos sejtek közelébe helyezik. Ennek az eljárásnak az az előnye, hogy a radioaktyv anyagnak nem kell a test egészséges szövetein keresztülhatolni míg eljut a célterületre, így hatása sokkal jobban lokalizált. Ez azt jelenti, hogy viszonylag nagy dózisok adhatók minimális kockázattal. Ezen túl a páciens is szabadon mozoghat a kezelés alatt. A teljes beavatkozás rendszerint hamarabb lezajlik, mint más eljárások, így a rákos sejteknek kevesebb idejük jut az osztódásra.
A brahyterápia bevett gyakorlat a nőgyógyászatban, különösen méhnyakrák, illetve a prosztatarák kezelésében, de sokszor alkalmazzák egyes fej- és nyaki daganatok esetén is. A prosztata megbetegedésekor számos megközelítés lehetséges, amelyet többnyire a kiválasztott izotóp határoz meg. A 125I (60 napos felezési idő) és a 103Pd (17 napos felezési idő) izotópokat maradandó implantátumokként helyezik el. Ezeket az izotópokat neutronbefogási reakciók felhasználásával készítik reaktorokban. A 103Pd-ot hatékonyabban lehet ciklotronokban (14 MeV-es protonnyalábbal) gyártani. Az Egyesült Államokban már 10 éves tapasztalattal rendelkeznek a prosztatarák 103Pd-as brachyterápia általi kezelésében. Az kitűnő eredmények és a mellékhatások hiánya miatt nagyon népszerűvé vált ez az eljárás.
A Nap látható és infravörös sugárzást bocsát ki, amelyet hőként érzékelünk, de ultraibolya sugárzás is eljut hozzánk, amely sajnos veszélyes lehet. Az ultraibolya sugárzás bőrmelanómát (bőrrák) okozhat. A bőrrák a leggyakoribb rákfajta és 2008-ban például 46000 ember haláláért volt felelős világszerte.
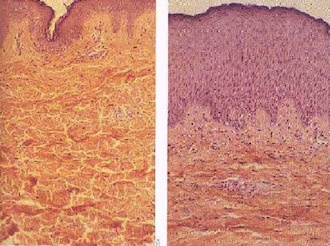
Az utóbbi 30 évben a rosszindulatú melanómával diagnosztizáltak száma megnégyszereződött. Leginkább a 40 év felettiek, világoshajúak, világosbőrűek, és olyanok a veszélyeztetettek, akik családjában már előfordult bőrrák. Azonban mindenkiben kifejlődhet rák fajtól, életkortól vagy genetikai háttértől függetlenül. A legtöbb bőrkárosodás 20 éves kor előtt keletkezik, de nem jelenik meg 40 éves kor előtt, azaz még ha nem is érezzük, a bőrünk károsodhat. Ezért nagyon fontos, hogy napkrémmel védjük a bőrünket, és ne menjünk a napra, amikor az a legerősebben süt (11 és 15 óra között).
