Μπορεί να έχετε ήδη ακούσει κάτι που ονομάζουμε στοιχείο. Κάθε υλικό που συναντούμε στην καθημερινότητά μας, συμπεριλαμβανομένων των ιστών και των οστών μας, αποτελείται από αυτά τα στοιχεία και υπάρχει ένας εκπληκτικά μικρός αριθμός από αυτά.
Τι κάνει ένα στοιχείο διαφορετικό από το άλλο;
Αυτή η ερώτηση θα απαντηθεί πληρέστερα όταν θα συνεχίσουμε να εξηγούμε λεπτομερέστερα τη δομή των ατόμων.
Τα στοιχεία διαφέρουν στην ατομική κλίμακα. Ο χρυσός έχει διαφορετικές ιδιότητες από το μαγνήσιο επειδή τα
μεμονωμένα άτομα του υλικού έχουν ελαφρώς διαφορετικές δομές. Αυτή η διαφορά μπορεί να επηρεάσει τις φυσικές
του ιδιότητες, όπως η εμφάνιση του στοιχείου στην καθαρή μορφή του (για παράδειγμα ο χρυσός είναι
μια λαμπερή, σκληρή, κίτρινη ουσία, ενώ το μαγνήσιο είναι αργυρόχρωμο και πιο εύκαμπτο) και, κυρίως, τις χημικές ιδιότητες ή
πώς αλληλεπιδρά με
άλλες ουσίες (ο χρυσός είναι εξαιρετικά αδρανής, ενώ το μαγνήσιο αντιδρά εύκολα με το νερό). Οι δομικές διαφορές τους
επηρεάζουν επίσης τον
τρόπο με τον οποίο συνδυάζονται με άλλα στοιχεία.
Υπάρχει ένα χρήσιμο εργαλείο, που ονομάζεται Περιοδικός Πίνακας, το οποίο οργανώνει τα στοιχεία σύμφωνα με την ατομική
τους δομή και, κατά
συνέπεια, τις ιδιότητές τους. Θα εξεταστεί και αυτό με περισσότερες λεπτομέρειες αργότερα.
Τα στοιχεία που συνθέτουν όλα όσα βλέπουμε δεν μπορούν να παραχθούν τεχνητά, αλλά τα βρίσκουμε στη φύση. Από πού προέρχεται λοιπόν όλος ο άνθρακας από τον οποίο πρoερχόμαστε εμείς οι ίδιοι; Όλα τα σταθερά στοιχεία που βλέπουμε προέρχονται στην πραγματικότητα από πολύ πιο πέρα από τη Γη, από το διάστημα. Τα ελαφρά στοιχεία μέχρι το σίδερο, παράγονται σε μια διαδικασία που ονομάζεται πυρηνοσύνθεση μέσα στους πυρήνες των αστεριών. Στοιχεία πιο πάνω από αυτόν παράγονται όταν τα αστέρια πεθαίνουν σε γιγάντιες εκρήξεις που ονομάζονται υπερκαινοφανείς (σουπερνόβα). Και οι δύο αυτές διαδικασίες θα εξηγηθούν λεπτομερέστερα σε μια μεταγενέστερη ενότητα. Αυτό μπορεί να σας δώσει μια ένδειξη για το λόγο που υπάρχει περισσότερος άνθρακας από ό,τι χρυσός στο Σύμπαν, αν σκεφτείτε ότι μόνο τα πιο βαριά αστέρια μπορούν να κάψουν βαρύτερα στοιχεία όπως ο χρυσός και να μετατραπούν σε υπερκαινοφανείς αστέρες.
Η υπόθεση της ύπαρξης των ατόμων διατυπώθηκε στην εποχή των αρχαίων Ελλήνων, όταν ο φιλόσοφος Δημόκριτος
συνειδητοποίησε ότι μετά από ένα συγκεκριμένο σημείο δεν μπορούσε πλέον να κόψει το ψωμί του περισσότερο:
ήταν αδιαίρετο. Πρότεινε ότι όλα πρέπει να αποτελούνται από μερικά θεμελιώδη τμήματα, τα οποία δεν
μπορούν να καταστραφούν, και τα ονόμασε έτσι από την ελληνική λέξη «άτομος», που σημαίνει
«αυτός που δεν κόβεται».
Ωστόσο, μια πιο σύγχρονη θεώρηση των ατόμων άρχισε με την πρόοδο της χημείας. Ο John Dalton
παρατήρησε ότι 8 γραμμάρια οξυγόνου συνδυάζονταν πάντα με 1 γραμμάριο υδρογόνου ακριβώς.
Αυτό οδήγησε στη θεωρία ότι ένας ορισμένος αριθμός αντικειμένων σε μια μικροσκοπική κλίμακα ενός
στοιχείου πρέπει να συνδυάζεται με έναν ορισμένο αριθμό άλλων και κάθε ένα από αυτά τα αντικείμενα
ήταν διαφορετικό για κάθε στοιχείο. Αυτό εξελίχθηκε στην ιδέα των ατόμων. Ενώ οι χημικοί είχαν τη βασική
ιδέα των ατόμων, οι φυσικοί ανακάλυψαν ότι υπήρχαν περισσότερα για το άτομο από ό,τι πίστευαν αρχικά.
Η ανακάλυψη του πυρήνα
Όταν τα άτομα έγιναν μια αποδεκτή έννοια της δομής της ύλης σε μια πολύ μικρή κλίμακα,
οι επιστήμονες άρχισαν να διατυπώνουν θεωρίες για το τι έδωσε σε ένα άτομο τις ιδιότητές του,
γιατί τα άτομα του χρυσού συμπεριφέρονται διαφορετικά από τα άτομα μαγνησίου. Μία από τις πιο
ευρέως αποδεκτές θεωρίες ήταν αυτή του "σταφιδόψωμου". Σε αυτό το μοντέλο, το άτομο ήταν μια
θάλασσα θετικών φορτίων με διάσπαρτα αρνητικά φορτία, τα οποία στη συνέχεια ακύρωναν
το ένα το άλλο έτσι, ώστε τελικά το άτομο να είναι ουδέτερο.
Η πρώτη απόδειξη ότι η πραγματική δομή ήταν τελείως διαφορετική βρέθηκε στο φημισμένο πείραμα
του Rutherford το 1911. Ο ίδιος βομβάρδισε ένα φύλλο χρυσού (πάχους μόνο μερικών ατόμων)
με αυτό που γνώριζαν τότε ως σωματίδια άλφα, θετικά φορτισμένα σωματίδια, τα οποία σήμερα είναι
γνωστά ως πυρήνες ηλίου. Διαπίστωσε ότι αντί όλα τα σωματίδια να κατευθύνονται κατευθείαν πίσω
στον ανιχνευτή μετά το χτύπημα πάνω στα άτομα (μόνο μια πολύ μικρή ποσότητα), μερικά εκτρέπονταν
σε μικρές γωνίες και μερικά περνούσαν κατευθείαν μέσα από το φύλλο. Αυτό ενέπνευσε τον Rutherford
να καταλήξει στο συμπέρασμα ότι τα άτομα έχουν στην πραγματικότητα έναν πολύ μικρό όγκο θετικού
φορτίου στο κέντρο, που ανάγκασε τα σωματίδια άλφα που τον χτύπησαν κεντρικά να γυρίσουν πίσω.
Συνειδητοποίησε επίσης ότι ένα μεγάλο μέρος του ατόμου πρέπει να αποτελείται από κενό χώρο για να
περάσει ευθεία η πλειονότητα των σωματιδίων. Εκείνα τα σωματίδια που εκτρέπονταν ελαφρά έπρεπε
να είχαν περάσει πολύ κοντά από το θετικό φορτίο στο κέντρο και είχαν απωθηθεί από ομώνυμο φορτίο.
Το τελικό του μοντέλο συνίστατο σε μια μικροσκοπική μπάλα θετικού φορτίου στο κέντρο του ατόμου,
την οποία θεώρησε ως τον πυρήνα, και για να εξασφαλίσει ότι το άτομο ήταν ουδέτερο, υπήρχαν αρνητικά
ηλεκτρόνια σε τροχιά γύρω από αυτόν με τρόπο παρόμοιο με τις πλανητικές τροχιές. Αυτό το μοντέλο
ήταν η αποδεκτή θεωρία μέχρι λίγο πιο σύγχρονα πειράματα κβαντικής φυσικής να δείξουν ότι αυτό
δεν ήταν επακριβώς σωστό.
Ο πυρήνας
Όπως υποδηλώνει ο τίτλος, οι πυρηνικοί φυσικοί επικεντρώνονται στη συμπεριφορά των ατομικών πυρήνων,
οπότε είναι σημαντικό να κατανοήσουν τη δομή τους. Τα ηλεκτρόνια είχαν ήδη ανακαλυφθεί από τον JJ Thomson
όταν έδειξε ότι οι καθοδικές ακτίνες αποτελούσαν στην πραγματικότητα αρνητικά φορτισμένα σωματίδια, των
οποίων ο ακριβής λόγος φορτίου / μάζας μετρήθηκε αργότερα στο πείραμα του Millikan με τις φορτισμένες σταγόνες
λαδιού. Είχε προταθεί πολλά χρόνια πριν από το πείραμα του Rutherford ότι όλα τα άτομα ήταν κατασκευασμένα
από άτομα υδρογόνου, το οποίο ήταν σχεδόν σωστό. Το 1917, ο Rutherford πραγματοποίησε ένα πείραμα που
περιελάμβανε την εκτόξευση σωματιδίων άλφα μέσα σε καθαρό αέριο άζωτο. Οι ανιχνευτές του έδωσαν σήματα
για πυρήνες υδρογόνου και έτσι κατέληξε στο συμπέρασμα ότι πρέπει να έχουν εκπέσει από τους πυρήνες αζώτου
μετά από συγκρούσεις με τα σωματίδια άλφα. Αποφάσισε ότι αυτό σήμαινε ότι ο πυρήνας του αζώτου περιείχε
πυρήνες υδρογόνου ή πρωτόνια. Αυτή θεωρείται η πρώτη καταγεγραμμένη πυρηνική αντίδραση.
Σε αυτό το σημείο, οι επιστήμονες είχαν αναπτύξει την έννοια των μαζικών και ατομικών αριθμών.
Ο μαζικός αριθμός είναι η πραγματική μάζα του ατόμου (μπορούμε όντως να υποθέσουμε ότι είναι η μάζα του
πυρήνα, καθώς τα ηλεκτρόνια έχουν αμελητέα μάζα) και ο ατομικός αριθμός είναι ο αριθμός των πρωτονίων
ή ο αριθμός των ηλεκτρονίων στο άτομο. Η ύπαρξη του νετρονίου υποδείχθηκε για πρώτη φορά από τον
Rutherford το 1920 για να εξηγήσει την αντίφαση μεταξύ των ατομικών αριθμών και του αριθμού μάζας των
πυρήνων. Ωστόσο, ήταν ο James Chadwick το 1932 που έδειξε ότι η ακτινοβολία που προηγουμένως θεωρούνταν
ακτίνες γάμμα αποτελούσε ουσιαστικά ουδέτερα σωματίδια μάζας περίπου ίσης με εκείνη των πρωτονίων.
Τα σωματίδια ονομάστηκαν νετρόνια και προσαρμόστηκαν στην πυρηνική θεωρία ως η μάζα που έλειπε.
Ο συλλογικός όρος για τα πρωτόνια και τα νετρόνια, που βρίσκονται και τα δύο μέσα στον πυρήνα είναι νουκλεόνια.
Τα νουκλεόνια συγκρατούνται από την ισχυρή δύναμη, η οποία είναι μία από τις τέσσερις θεμελιώδεις δυνάμεις
του σύμπαντος. Αυτή η συγκεκριμένη δύναμη είναι περίπου 1038 φορές ισχυρότερη από τη βαρύτητα,
δρα μόνο σε απόσταση 10-15 m και ξεπερνά την ηλεκτροστατική άπωση μεταξύ των ομοίων θετικών
φορτίων των πρωτονίων.
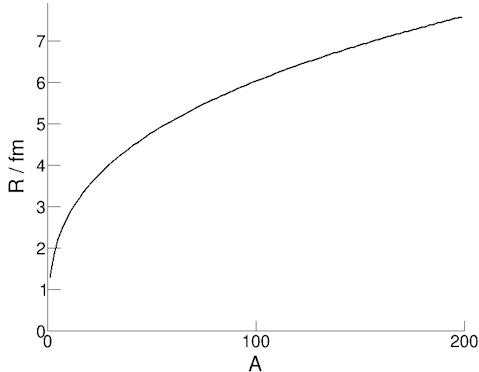
Μπορούμε να βρούμε την ακτίνα ενός πυρήνα διασκορπίζοντας ηλεκτρόνια από τους πυρήνες και μελετώντας
το μοτίβο. Ενώ μπορούμε να κάνουμε έναν υπολογισμό χρησιμοποιώντας τη διατήρηση της ορμής σε
αυτό το σενάριο, πειράματα έχουν δείξει ότι η εξίσωση για την ακτίνα μπορεί να προσεγγιστεί από τον τύπο:
R = r0 A1/3
όπου R είναι η πυρηνική ακτίνα, Α είναι ο αριθμός των νουκλεονίων και r0 είναι μια σταθερά (η ακτίνα ενός νουκλεονίου ≈ 1.3 fm).