Mogłeś już kiedyś słyszeć, że jest coś, co nazywamy pierwiastkiem. Każdy materiał, z którym mamy do czynienia na co dzień, włączając w to nasze tkanki i kości, zbudowany jest właśnie z pierwiastków, i to w dodatku ze stosunkowo niedużej ich liczby.
Co sprawia, że jeden pierwiastek różni się od drugiego?
Bardziej wyczerpująca odpowiedź na to pytanie zostanie udzielona wtedy, gdy przejdziemy do szczegółowego
wyjaśnienia struktury atomów. Natomiast teraz, bez wchodzenia w szczegóły, możemy powiedzieć, że
pierwiastki różnią się już w skali atomowej; np. złoto posiada własności różne od magnezu, ponieważ
pojedyncze atomy tych materiałów posiadają odmienną strukturę. Różnice w strukturze atomów przekładają
się na różnice we własnościach fizycznych materiałów (na przykład złoto jest błyszczącą, twardą i żółtą
substancją, podczas gdy magnez jest srebrny i bardziej elastyczny) i na różnice we własnościach
chemicznych. Odmienności te decydują też o różnicach w oddziaływaniu pierwiastków z innymi substancjami
(złoto jest
wyjątkowo niereaktywne, natomiast magnez łatwo wchodzi w reakcję z wodą) oraz o możliwościach połączeń
między atomami.
Bardzo użytecznym narzędziem, które systematyzuje pierwiastki ze względu na ich strukturę atomową, a tym
samym ze względu na własności, jest tzw. układ okresowy pierwiastków. Wkrótce zajmiemy się nim bardziej
szczegółowo.
Pierwiastki, z których zbudowane jest to, co widzimy, nie mogły zostać wytworzone sztucznie - musiały istnieć w naturze już wcześniej. Ale skąd się wzięły? Skąd pochodzi na przykład węgiel, który jest jednym z głównych naszych budulców? Otóż okazuje się, że stabilne pierwiastki tworzące Ziemię i wszystko, co się na niej znajduje, powstały w przestrzeni kosmicznej. Lekkie pierwiastki, do żelaza włącznie, są tworzone w procesie nazywanym nukleosyntezą, zachodzącą w jądrach gwiazd. Pierwiastki cięższe od żelaza powstają natomiast podczas gigantycznych eksplozji, do których dochodzi w czasie umierania niektórych gwiazd. Taka wybuchająca gwiazda nosi nazwę „supernowa” (oba wspomniane procesy będą omówione bardziej szczegółowo w późniejszych sekcjach). Jeżeli więc na przykład zauważysz, że tylko gwiazdy o dużej masie mogą wytwarzać ciężkie pierwiastki, gdyż tylko one mogą wybuchać jako supernowe, będziesz miał już częściową odpowiedź na pytanie dlaczego we Wszechświecie więcej jest węgla, niż złota.
Istnienie atomów przewidywane było już przez starożytnych Greków. Filozof Demokryt doszedł do wniosku,
że, w pewnym momencie, dzielenie chleba na coraz to mniejsze kawałki musi mieć kres - musi się dojść do
kawałka, który jest niepodzielny. Zasugerował więc, że wszystko składa się z niepodzielnych kawałków,
których nie można zniszczyć, i nazwał je greckim słowem „atomos” (po polsku „atomy”), co znaczy
„niepodzielne”.
Określenie pojęcia „atom”, które jest przyjęte obecnie, miało jednak swój początek w chemii. John Dalton
zauważył, że 8 gramów tlenu zawsze łączy się dokładnie z 1 gramem wodoru. Obserwacja ta zgodna była z
teorią, która zakładała, że pewna liczba obiektów jednego pierwiastka (co prawda niewidocznych gołym
okiem) musiała łączyć się z określoną liczbą obiektów drugiego pierwiastka, i że obiekty odpowiadające
różnym pierwiastkom były różne. Stąd było już niedaleko do wprowadzenia idei atomu. Istnienie atomów,
najmniejszych składników materii, jako pierwsi zaakceptowali chemicy, a tymi, którzy odkryli, że atom
jest bardziej tajemniczym obiektem, niż na początku sądzono, byli fizycy.
Odkrycie jądra atomowego
Po tym jak zaakceptowano ideę atomowej struktury materiałów, naukowcy zaczęli zastanawiać się nad źródłem
zróżnicowania własności atomów; dlaczego np. atomy złota zachowują się inaczej niż atomy magnezu. Jedną
z rozpowszechnionych wtedy teorii był model „puddingu śliwkowego”. W świetle tego modelu atom był
obiektem jednorodnie wypełnionym substancją o ładunku dodatnim z powtykanymi w nią ładunkami ujemnymi.
Ładunki wzajemnie się znosiły, wobec czego atom był elektrycznie neutralny.
Pierwszą przesłankę o tym, że struktura atomu jest całkowicie odmienna, dostarczył eksperyment
Rutherforda z 1911 r. Rutherford skierował na folię złota (o grubości kilku warstw atomowych) dodatnio
naładowane cząstki, już wtedy nazywane cząstkami alfa, a obecnie znane także jako jądra helu. Zauważył,
że nieliczne cząstki po uderzeniu w atom potrafiły się odbić nawet do tyłu, a większość z nich przechodziła
przez folię praktycznie bez zmiany kierunku. Rutherford zaproponował wyjaśnienie tego zjawiska: w środku
atomów muszą istnieć malutkie skupiska dodatniego ładunku, od których odbijają się cząstki centralnie
uderzające w te skupiska. Wyciągnął też inny niezwykle doniosły wniosek: atom jest w ogromnej większości
pusty, dzięki czemu prawie wszystkie cząstki alfa przechodzą przez folię bez przeszkód. Te natomiast
cząstki, których kierunek zmienił się nieznacznie, musiały przejść blisko dodatniego ładunku skupionego w
środku, który je odepchnął.
Rutherford zaproponował więc model zakładający istnienie w centrum atomu malutkiej, dodatnio naładowanej
kulki, którą nazwał jądrem.
Aby zapewnić elektryczną neutralność atomu, przyjął, że jądro obiegają ujemnie naładowane elektrony,
podobnie jak dzieje się to w układzie planetarnym. Model Rutherforda był akceptowany do czasu, kiedy
nowsze eksperymenty, związane z rozwojem mechaniki kwantowej, pokazały, że teoria ta nie jest w pełni
poprawna.
Jądro atomowe
Fizycy jądrowi, jak sugeruje sama nazwa, skupiają się na badaniu jąder atomowych, a więc kluczową dla
nich sprawą jest zrozumienie struktury tych obiektów.
Na wiele lat przed eksperymentem Rutherforda wysunięto hipotezę, że wszystkie atomy zbudowane są z atomów
wodoru (co nie było dalekie od prawdy). W 1917 r. Rutherford przeprowadził eksperyment, w którym
bombardował
cząstkami alfa czysty, gazowy azot. Ponieważ
detektory zarejestrowały jądra wodoru, odkrywca wywnioskował, że ich źródłem są jądra azotu, z których są
one wybijane w wyniku zderzeń. Stąd prosta konkluzja: w skład jąder azotu wchodzą jądra wodoru, czyli
protony. Opisany pomiar jest jednocześnie pierwszym zarejestrowanym przykładem badania reakcji jądrowej.
Wkrótce fizycy wprowadzili pojęcia masy atomowej i liczb atomowych.
Liczba masowa jest masą atomu (w zasadzie możemy założyć, że jest to jednocześnie masa jądra, gdyż masa
elektronów jest zaniedbywalnie mała), natomiast liczba atomowa to liczba protonów, albo, co jest równoważne,
liczba elektronów w atomie. W celu wyjaśnienia różnicy pomiędzy liczbami atomowymi i liczbami masowymi
jąder, Rutherford w 1920 roku zaproponował istnienie neutronu. Niemniej jednak dopiero James Chadwick w
roku 1932 udowodnił, ze promieniowanie, które na początku brano za strumień kwantów gamma, to nic innego
jak neutralne cząstki o masie zbliżonej do masy protonu. Cząstki te nazwano neutronami – weszły one do
teorii jądra atomowego jako te, które wyjaśniły ułamkowe wartości mas atomowych pierwiastków.
Protony i neutrony, tworzące jądra atomowe, nazywane są nukleonami. Nukleony wiązane są ze sobą za
pośrednictwem oddziaływania silnego, które jest jednym z czterech fundamentalnych oddziaływań we
Wszechświecie. Oddziaływanie silne jest w przybliżeniu 1038 razy silniejsze niż grawitacja,
ale działa na odległościach tylko 10-15 m. Przewyższa ono elektrostatyczne odpychanie pomiędzy
dodatnio naładowanymi protonami.
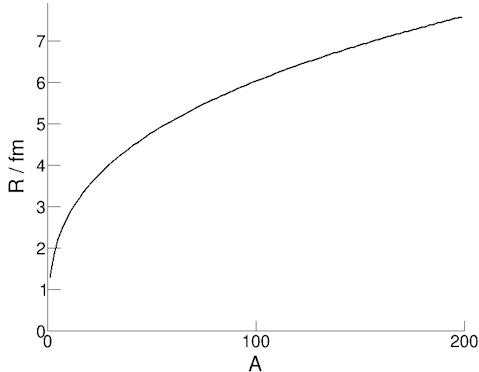
Promień jądra atomowego możemy zmierzyć na przykład za pomocą rozpraszania elektronów na jądrze oraz
analizy uzyskanych w takiej reakcji danych na temat ilości rozproszonych pod różnymi kątami elektronów.
Eksperymenty pokazały, że wyrażenie na promień jądra można przedstawić w postaci:
R = r0 A1/3
W wyrażeniu tym R oznacza promień, A jest liczbą nukleonów, a r0 jest stałą (promieniem nukleonu ≈ 1.3 fm).