Probabil sa fi auzit deja ceva despre ceea ce noi numim un element. Toate materialele cu care ne intalnim zilnic, inclusiv tesuturile și oasele umane, este facut din aceste elemente, și anume dintr-un numar surprinzator de mic.
Ce face ca un element sa se diferentieze de altul?
Raspunsul la aceasta intrebare va fi cu mai exact formulat atunci cand vom explica structura atomica în mod detaliat. Elementele se diferentiaza la scala atomica; aurul are proprietati diferite de magneziu pentru ca cei doi atomi corespunzatori au structura usor diferita. Aceste mici deosebiri pot determina proprietati fizice diferite, precum aspectul elementelor în stare naturala (aurul este o substanta stralucitoare, dura, de culoare galbena, în timp ce magneziul este argintiu și mult mai flexibil), dar cel mai important, se pot observa în proprietatile chimice sau modul în care interactioneaza cu alte substante (aurul nu este deloc reactiv, pe cand magneziul interactioneaza foarte usor cu apa). Diferentele structurale afecteaza, de asemenea, modul în care se pot combina cu alte elemente. Exista un instrument foarte util, numit tabelul periodic, în care elementele sunt organizate în functie de structura atomica si, în consecinta, de proprietatile lor. Acest tabel va fi prezentat, în detaliu, în alte sectiuni.
Elementele care stau la baza a tot ceea ce exista nu sunt produse în mod sintetic, ci se pot gasi în natura. Deci, de unde vine tot carbonul care intra și în componenta noastra? Toate elementele care se gasesc în stare stabila și pe care noi le putem vedea isi au originea undeva departe de Pamant, în spatiu. Elementele mai usoare decat fierul sunt produse intr-un proces numit nucleosinteza care are loc în interiorul stelelor. Elementele mai grele se formeaza atunci cand stelele mor în explozii uriase numite supernove. Ambele procese vor fi explicate în detaliu, în sectiunile ulterioare. Avem deja un indiciu la intrebarea “de ce exista mai mult carbon decat aur în Univers?” daca consideram ca doar cele mai mari stele pot produce nuclee grele precum aurul și deveni supernove.
Despre existenta atomilor s-au elaborat teorii inca de pe vremea Greciei Antice, cand filosoful Democritos a realizat ca de la un anumit punct nu-si mai poate taia painea în bucati oricat de mici: ea este indivizibila. El a sugerat ca totul trebuie sa fie construit din aceste piese fundamentale și care nu pot fi distruse și pe care le-a numit dupa cuvantul grecesc “atomos” care inseamna “nu mai poate fi taiat”.
In orice caz, o idee mult mai moderna despre atomi a aparut o data cu dezvoltarea chimiei. John Dalton a notat faptul ca 8 grame de oxigen intodeauna se combina exact cu un gram de hidrogen. Aceasta a condus la idea ca un anumit numar de “obiecte” la o scala mica a unui element trebuie sa se combine cu un anumit numar de “obiecte” al altui element și fiecare tip de obiect este diferit pentru fiecare element. Aceasta a evoluat în ideea de atom. Daca chimistii au inteles primii conceptul de “atom”, fizicienii au fost cei care au descoperit ca atomul este altceva decat ce si-au imaginat initial.
Descoperirea nucleului
Cand existenta atomilor a devenit o idee acceptata în privinta structurii materiei la o scala foarte mica, oamenii de stiinta au elaborat teorii despre cum sunt generate proprietatile caracteristice ale atomilor; “de ce atomii de aur sunt diferiti de atomii de magneziu?”. Una din cele mai acceptate teorii în aceasta privinta a fost modelul budincii cu stafide. Conform acestui model atomii reprezinta o mare de sarcini pozitive “presarata” cu sarcini negative care se anulau una pe cealalta, rezultand atomul neutru din punct de vedere electric.
Prima constatare a faptului ca structura reala a unui atom este complet diferita de ceea ce se credea initial a fost gasita de Rutherford în anul 1911. Intr-un experiment celebru, el a bombardat o foita subtire de aur (groasa de numai cativa atomi) cu ceea ce se cunostea a fi particule alfa; particule pozitive din punct de vedere electric care sunt cunoscute astazi ca fiind nuclee de heliu. El a observant urmatorul lucru: în loc ca toate particulele sa fie intoarse catre detector, unele particule erau imprastiate și deviate la unghiuri mici, iar altele treceau nedeviate prin tinta, desi rezultatul pe care il astepta era altul. Aceasta observatie l-a facut pe Rutherford sa concluzioneze ca atomii au un mic volum în centru unde se gasesc sarcinile pozitive ceea ce a facut ca particulele alfa sa fie retro-imprastiate. De asemenea, a realizat ca în mare parte atomul este format din spatiu gol astfel incat majoritatea particulelor au reusit sa treaca prin tinta nedeviate. Acele particule care au fost deviate, au trecut pe langa sarcina pozitiva din centrul atomului și au fost respinse datorita sarcinii electrice.
Modelul final consta dintr-o minge foarte mica în care se gaseste sarcina pozitiva și se afla în central atomului, minge pe care a numit-o nucleu și pentru a asigura neutralitatea atomului, din electronii care au sarcini negative și se invart în jurul nucleului, intregul sistem fiind asemanator cu sistemul planetar. Acest model teoretic a fost acceptat pana la aparitia fizicii cuantice care a aratat ca acesta nu este în totalitate corect.
Nucleul
Dupa cum sugereaza și titlul, oamenii de stiinta care activeaza în domeniul fizicii nucleare cerceteaza caracteristicile nucleelor atomice, aceasta fiind calea spre a intelege structura materiei. Electronii fusesera descoperiti de fizicianul J. J. Thomson, cand a aratat ca razele catodice constau din particule incarcate negativ din punct de vedere electric, al caror raport sarcina/masa a fost masurat mai tarziu de catre Millikan prin intermediul picaturilor de ulei incarcate. Cu multi ani inaintea experimentului lui Rutherford a fost exprimata idea ca toti atomii sunt formati din atomi de hidrogen, idee ce este aproximativ corecta. In anul 1917 Rutherford a efectuat un experiment care a constat din bombardarea cu particule alfa o tinta gazoasa de azot pur. Detectorii au aratat semnale datorate prezentei nucleelor de hidrogen astfel ajungand la concluzia ca acestea au fost emise din nucleele de azot dupa intercatia cu particulele alfa. Datorita acestui fapt a decis ca nucleele de azot contin nuclee de hidrogen sau protoni. Aceasta este considerata prima reactie nucleara consemnata.
La acest moment oamenii de stiinta dezvoltasera deja conceptele de masa atomica și numar atomic.
Numarul de masa este, de fapt, masa unui atom (putem considera ca e aceeasi cu masa nucleului, electronul avand masa neglijabila), iar numarul atomic reprezinta numarul de protoni sau numarul de electroni din atom. Existenta neutronilor a fost prima oara sugerata în anul 1920 de catre Rutherford ca urmare a diferentei dintre numarul atomic și numarul de masa al nucleelor. Totusi, abia în anul 1932 James Chadwik a fost cel care a aratat ca radiatia despre care se credea ca este de tip gama, consta, de fapt, din particule neutre a caror masa este aproximativ egala cu masa protonilor. Particulele au fost denumite neutroni și au fost introduse în teoria nucleara pentru a explica diferenta de masa.
Termenul colectiv pentru protoni și neutroni, ambele tipuri de particule gasindu-se în nucleu, este acela de nucleoni. Nucleonii sunt tinuti impreuna de forta tare care face parte dintre cele patru tipuri de forte fundamentale din Univers. Aceasta forta este de aproximativ de 1038 ori mai puternica decat forta gravitationala, actioneaza la distante de ordinul a 10-15 m și invinge forta de repulsie coulombiana dintre particule cu acceasi sarcina.
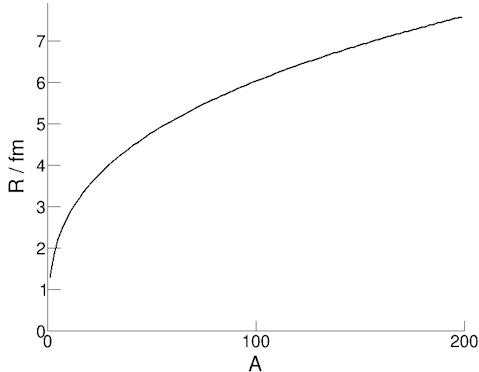
Putem determina raza nucleului bombardand nucleele cu fascicule de electroni și studiind distributia unghiurilor de imprastiere. Se pot face calcule exacte pe baza acestei idei, folosind conservarea impulsului, insa masuratorile au aratat ca raza nucleului poate fi bine aproximata de urmatoarea formula:
R = r0 A1/3
in aceasta ecuatie R reprezinta raza nucleului, A este numarul de nucleoni, iar r0 este o constanta (raza unui nucleon ≈ 1.3 fm).