Potresti aver già sentito parlare di qualcosa che viene chiamata elemento. Ciascun materiale che incontriamo nella vita di tutti i giorni, includendo i nostri stessi tessuti ed ossa, è fatto da questi elementi, ma il numero di elementi esistenti è sorprendentemente piccolo.
Che cosa rende un elemento diverso da un altro?
Questa questione sarà chiarita meglio quando spiegheremo la struttura degli atomi in maggior dettaglio.
Gli elementi differiscono su scala atomica; l'oro ha proprietà differenti dal magnesio perché i singoli atomi di materiali differenti hanno struttere leggermente diverse. Questa differenza può affliggere le proprietà fisiche, come l'apparenza degli elementi nella loro forma pura (per esempio l'oro è una sostanza lucente, dura, gialla, mentre il magnesio è argenteo e più flessibile), e più importante, le proprietà chimiche, o come questi interagiscono con altre sostanze (l'oro è estremamente inattivo, mentre il magnesio reagirà prontamente con l'acqua). Le loro differenze di struttura inoltre influenzano come si combinano con gli altri elementi.
Esiste uno strumento utile, chiamato Tavola Periodica, che organizza gli elementi secondo la loro struttura atomica, e conseguentemente, le loro proprietà. Lo vedremo più in dettaglio dopo.
Si vede che gli elementi che formano qualsiasi cosa non possono essere prodotti sinteticamente, ma sono piuttosto reperiti naturalmente. Dunque, da dove proviene tutto il carbonio di cui siamo fatti? Tutti gli elementi stabili che possiamo osservare sono stati originati ben lontano dalla Terra, nello spazio. Gli elementi leggeri fino al ferro sono prodotti in un processo chiamato nucleosintesi, che avviene nei nuclei delle stelle. Gli elementi sopra il ferro si formano quando le stelle terminano la loro vita attraverso grandi esplosioni chiamate supernovae. Entrambi questi processi verrano spiegati in maggior dettaglio in una sezione successiva. Questo ti può fornire un'indicazione sul perché ci sia più carbonio che oro nell'Universo, se consideri che solo le stelle più massive possono bruciare gli elementi pesanti come l'oro e finire in supernovae.
L'esistenza degli atomi fu teorizzata sin dal periodo degli antichi Greci, quando il filosofo Democrito comprese che ad un certo punto, lui non riusciva a tagliare il pane in fette più sottili: era indivisibile. Egli suggerì che qualsiasi cosa deve essere fatta di blocchi fondamentali, che non possono essere distrutti, e li chiamò con la parola greca ‘atomos’, che significa ‘non divisibile’.
Comunque, un'idea più moderna di atomi è arrivata con il progresso della chimica. John Dalton notò che 8 grammi di ossigeno si combinavano sempre esattamente con 1 grammo di idrogeno. Questo fatto condusse alla teoria che un certo numero di oggetti di un elemento su scala minuscola deve combinarsi con un certo numero di un altro, e combinazioni diverse portavano a materiali diversi. Questo concetto si è evoluto nell'idea di atomo. Mentre i chimici avevano l'idea base dell'atomo, sono stati i fisici a scoprire che c'era di più negli atomi di quello che i primi avessero pensato.
La scoperta del nucleo
Quando gli atomi divennero l'idea accettata per descrivere la struttura dei materiali a scala molto piccola, gli scienziati iniziarono a teorizzare che cosa desse all'atomo le sue proprietà, sul perchè gli atomi dell'oro si comportano diversamente da quelli del magnesio.
Una tra le teorie maggiormente condivise era il ‘modello a panettone’. In questo modello, l'atomo viene rappresentato come un mare di cariche positive cosparso da cariche negative, che si cancellano l'una con l'altra in modo che l'intero atomo sia neutro.
La prima evidenza che la struttura reale fosse completamente differente venne scoperta nel 1911 con il famoso esperimento di Rutherford.
Egli bombardò una lamina d'oro (spessa solo pochi atomi) con quelle che erano conosciute come particelle alpha, particelle cariche positivamente, che oggi sappiamo essere nuclei di elio. Egli trovò che, dopo aver urtato gli atomi, le particelle invece di essere rimbalzate all'indietro verso il rivelatore (solo una piccola parte lo faceva), alcune venivano deflesse a piccoli angoli e altre passavano dritte attraverso la lamina. Queste osservazioni ispirarono Rutherford a concludere che gli atomi in realtà fossero formati da un piccolo volume di cariche positive al centro, che causavano il rimbalzo delle particelle alpha che le urtavano. Egli inoltre realizzò che la maggior parte dell'atomo comprendeva dello spazio vuoto attraverso il quale passava la maggioranza delle particelle.
Quelle particelle che erano state deflesse leggermente dovevano essere passate molto vicino alla carica positiva al centro ed essere respinte dallo stesso tipo di carica.
Il suo modello finale consisteva di una minuscola palla di carica positiva al centro dell'atomo, il quale egli giudicò il nucleo, e, in modo da assicurare che l'intero atomo fosse neutro, degli elettroni negativi che orbitavano intorno al nucleo in modo simile alle orbite dei pianeti.
Questo modello ha rappresentato la teoria accettata fino a che esperimenti di fisica quantistica leggermente più moderni hanno mostrato che questo non era completamente corretto.
Il nucleo
Come suggerisce il titolo, i fisici nucleari si concentrano sul comportamento dei nuclei degli atomi, per capire la sua struttura. Gli elettroni erano già stati scoperti da J.J. Thomson quando mostrò che i raggi catodici effettivamente consistevano di particelle cariche negative, delle quali l'esatto rapporto carica/massa venne misurato più tardi nell'esperimento di Millikan con gocce di olio cariche. Molti anni prima dell'esperimento di Rutherford era stato suggerito che tutti gli atomi erano composti da atomi di idrogeno, cosa quasi corretta. Nel 1917, Rutherford condusse un esperimento che riguardava il bruciare particelle alfa all'interno di un gas di azoto puro. Il suo rivelatore mostrò i segnali per i nuclei d'idrogeno e lui concluse che dovevano essere stati emessi dagli atomi di azoto dopo le collisioni con le particelle alfa. Egli sostenne che questo fatto dimostrava che gli atomi di azoto contenevano i nuclei di idrogeno, o protoni. Questa viena considerata la prima reazione nucleare documentata.
A quasto punto gli scienziati avevano sviluppato il concetto di massa e di numero atomico.
Il numero di massa è la massa reale dell'atomo (si può assumere che effettivamente sia anche la massa del nucleo, dal momento che gli elettroni hanno massa trascurabile) e il numero atomico è il numero di protoni, o il numero di elettroni nell'atomo.
L'esistenza del neutrone fu suggerita per prima da Rutherford nel 1920 per tenere conto della discrepanza tra il numero atomico e il numero di massa dei nuclei. Comunque, fu James Chadwick nel 1932 che mostrò che la radiazione precedentemente ritenuta essere raggi gamma fosse in realtà formata da particelle neutre di massa approssimativamente pari a quella dei protoni. Queste particelle vennero chiamate neutroni e vennero inserite nella teoria del nucleo, nel ruolo della massa mancante.
Il termine collettivo per i protoni ed i neutroni, entrambi i quali risiedono nel nucleo, è nucleoni. I nucleoni sono tenuti insieme dalla forza forte, che è una delle quattro forze fondamentali nell'Universo. Questa particolare forza è circa 1038 volte più forte della gravità, agisce solo entro una distanza di 10-15 m, e supera la repusione elettrostatica tra le cariche positive dei protoni.
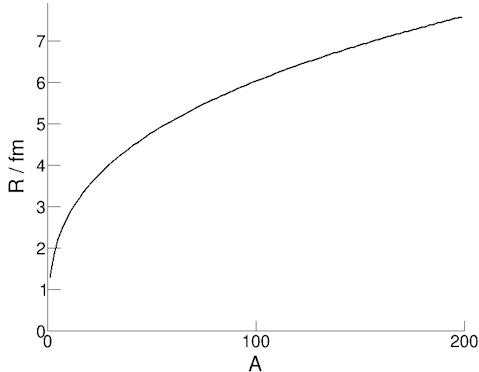
Si può stimare il raggio di un nucleo studiando le traiettorie degli elettroni che vengono deflesse dall'urto con i nuclei. Mentre è possibile fare il calcolo usando la conservazione del momento angolare in questo modello, li esperimenti hanno dimostrato che l'equazione per il raggio è approssimabile con la formula:
R = r0 A1/3
dove R è il raggio nucleare, A il numero dei nucleoni e r0 una costante (il raggio di un nucleone ≈ 1.3 fm).